摘要:系统生物学研究所(ISB)的研究人员开发了一种新的方法来模拟个性化的微生物组介导的饮食反应。
短链脂肪酸(SCFAs)是由我们肠道中的细菌产生的有益分子,与改善宿主代谢、降低全身炎症、促进心血管健康、降低癌症风险等密切相关。然而,即使在饮食完全相同的个体之间,SCFA的谱系也可能存在显著差异。目前,我们缺乏预测这种个体间差异的工具。
系统生物学研究所(ISB)的研究人员开发了一种新的方法,用以模拟个性化的微生物组介导的饮食反应。他们采用了微生物群落规模代谢模型(MCMM)来预测个体特异性SCFA产量对不同饮食、益生元和益生菌输入的响应。
换句话说,ISB的科学家能够构建一个肠道微生物组代谢的“数字双胞胎”,模拟对饮食的个性化反应。他们使用肠道微生物组测序数据和饮食摄入信息来定制每个个体特定的模型。他们的研究结果已在《Nature Microbiology》杂志上发表。

图1 微生物群落规模的代谢模型预测人类肠道中个性化的短链脂肪酸生产概况
ISB的副教授、共同资深作者Sean Gibbons博士指出:“粗略地说,肠道微生物组是一个生物反应器,可以将膳食纤维转化为这些SCFAs。了解肠道生态和饮食摄入如何定量映射到SCFA输出,将代表将微生物组科学转化为临床的重大进步。”
与黑箱机器学习预测方法不同,MCMM是透明和机械的,它涵盖了数十种生物体中的数万种代谢物和酶,提供了关于特定微生物、饮食成分和代谢途径的深入知识,有助于生成SCFA。尽管具有这种透明性,但这些模型的复杂性使它们难以通过实验验证。
为了克服这一挑战,作者测量了体外人类肠道细菌分离菌随机混合物群落和不同人的粪便均质物在厌氧室中与各种膳食纤维孵育时的SCFA产量。通过从宿主吸收中分离微生物驱动的SCFA生产,ISB科学家能够证明MCMM预测与测量的纤维范围内丁酸盐和丙酸盐的生产速率显著相关,这两种纤维是最丰富和生理上有效的SCFA。
尽管体内测量丁酸盐和丙酸盐的产量是不可行的,但作者能够使用SCFA产量与基于血液的健康标志物之间的间接关联来验证个体间产量差异的生理影响。他们发现,MCMM预测可以区分高纤维喂养研究中表现出不同免疫反应的个体:大多数个体表现出全身炎症标志物的减少,但一小部分人在高纤维饮食中表现出炎症的增加。根据MCMM的预测,高炎症反应组的个体产生丙酸的能力显著降低。此外,丁酸盐预测与心脏代谢和免疫健康的血液标志物显著相关。
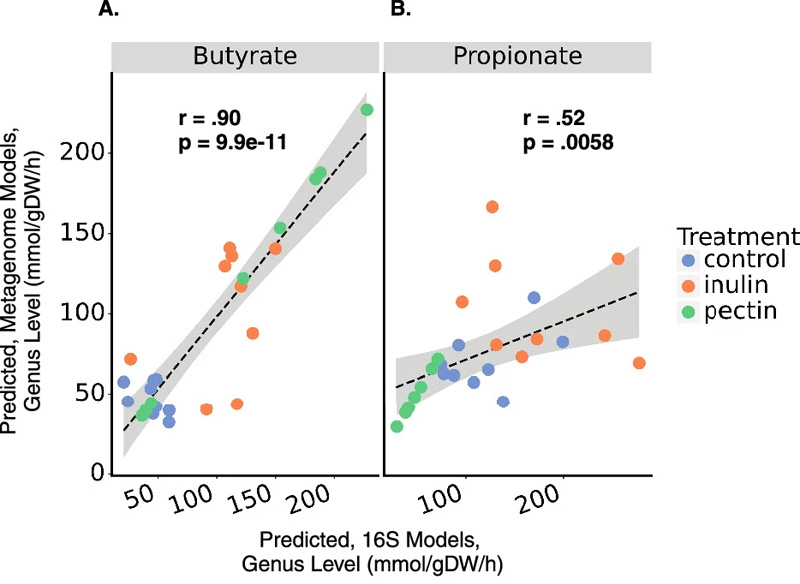
图2 使用16S扩增子测序或鸟枪宏基因组测序数据对SCFA产生的预测显示出一致性
首席作者Nick Quinn-Bohmann博士表示:“MCMM在体外的预测准确性,加上SCFA预测与人类群体健康指标之间的显著关联,使我们对这些模型在精确营养方面的效用充满信心。”
在验证MCMM预测后,作者展示了该方法在设计个性化益生元、益生菌和饮食干预以优化SCFA生产概况方面的潜力。他们模拟了两种不同饮食的丁酸盐产量,并研究了来自美国太平洋西部的2000多人。他们发现,一小部分个体在转向高纤维饮食时,丁酸盐的产生几乎没有增加(称为“无反应者”),而另一部分个体在高纤维饮食时,丁酸盐的产生实际上有小幅下降(称为“回归者”)。接下来,他们在两种背景饮食中模拟了三种简单的联合干预措施,试图增加无反应和回归者的丁酸盐产量:添加益生元纤维菊粉,添加益生元纤维果胶,或添加产生丁酸盐的益生菌(Faecalibacterium)。结果表明,没有单一的组合干预对所有个体都是最佳的:一些人从添加益生元纤维中获益最多,而另一些人似乎需要在他们的微生物群中添加一种产生丁酸盐的益生菌。
奥地利格拉茨医科大学的助理教授、资深作者Christian Diener博士说:“总之,这些结果为微生物组介导的精准营养的新途径提供了重要的概念证明。但是,在进入临床实践之前,还有更多的工作要做,以验证这些模型在前瞻性人体试验中的预测能力。”
参考资料
[1] Microbial community-scale metabolic modelling predicts personalized short-chain fatty acid production profiles in the human gut
摘要:系统生物学研究所(ISB)的研究人员开发了一种新的方法来模拟个性化的微生物组介导的饮食反应。
短链脂肪酸(SCFAs)是由我们肠道中的细菌产生的有益分子,与改善宿主代谢、降低全身炎症、促进心血管健康、降低癌症风险等密切相关。然而,即使在饮食完全相同的个体之间,SCFA的谱系也可能存在显著差异。目前,我们缺乏预测这种个体间差异的工具。
系统生物学研究所(ISB)的研究人员开发了一种新的方法,用以模拟个性化的微生物组介导的饮食反应。他们采用了微生物群落规模代谢模型(MCMM)来预测个体特异性SCFA产量对不同饮食、益生元和益生菌输入的响应。
换句话说,ISB的科学家能够构建一个肠道微生物组代谢的“数字双胞胎”,模拟对饮食的个性化反应。他们使用肠道微生物组测序数据和饮食摄入信息来定制每个个体特定的模型。他们的研究结果已在《Nature Microbiology》杂志上发表。

图1 微生物群落规模的代谢模型预测人类肠道中个性化的短链脂肪酸生产概况
ISB的副教授、共同资深作者Sean Gibbons博士指出:“粗略地说,肠道微生物组是一个生物反应器,可以将膳食纤维转化为这些SCFAs。了解肠道生态和饮食摄入如何定量映射到SCFA输出,将代表将微生物组科学转化为临床的重大进步。”
与黑箱机器学习预测方法不同,MCMM是透明和机械的,它涵盖了数十种生物体中的数万种代谢物和酶,提供了关于特定微生物、饮食成分和代谢途径的深入知识,有助于生成SCFA。尽管具有这种透明性,但这些模型的复杂性使它们难以通过实验验证。
为了克服这一挑战,作者测量了体外人类肠道细菌分离菌随机混合物群落和不同人的粪便均质物在厌氧室中与各种膳食纤维孵育时的SCFA产量。通过从宿主吸收中分离微生物驱动的SCFA生产,ISB科学家能够证明MCMM预测与测量的纤维范围内丁酸盐和丙酸盐的生产速率显著相关,这两种纤维是最丰富和生理上有效的SCFA。
尽管体内测量丁酸盐和丙酸盐的产量是不可行的,但作者能够使用SCFA产量与基于血液的健康标志物之间的间接关联来验证个体间产量差异的生理影响。他们发现,MCMM预测可以区分高纤维喂养研究中表现出不同免疫反应的个体:大多数个体表现出全身炎症标志物的减少,但一小部分人在高纤维饮食中表现出炎症的增加。根据MCMM的预测,高炎症反应组的个体产生丙酸的能力显著降低。此外,丁酸盐预测与心脏代谢和免疫健康的血液标志物显著相关。

图2 使用16S扩增子测序或鸟枪宏基因组测序数据对SCFA产生的预测显示出一致性
首席作者Nick Quinn-Bohmann博士表示:“MCMM在体外的预测准确性,加上SCFA预测与人类群体健康指标之间的显著关联,使我们对这些模型在精确营养方面的效用充满信心。”
在验证MCMM预测后,作者展示了该方法在设计个性化益生元、益生菌和饮食干预以优化SCFA生产概况方面的潜力。他们模拟了两种不同饮食的丁酸盐产量,并研究了来自美国太平洋西部的2000多人。他们发现,一小部分个体在转向高纤维饮食时,丁酸盐的产生几乎没有增加(称为“无反应者”),而另一部分个体在高纤维饮食时,丁酸盐的产生实际上有小幅下降(称为“回归者”)。接下来,他们在两种背景饮食中模拟了三种简单的联合干预措施,试图增加无反应和回归者的丁酸盐产量:添加益生元纤维菊粉,添加益生元纤维果胶,或添加产生丁酸盐的益生菌(Faecalibacterium)。结果表明,没有单一的组合干预对所有个体都是最佳的:一些人从添加益生元纤维中获益最多,而另一些人似乎需要在他们的微生物群中添加一种产生丁酸盐的益生菌。
奥地利格拉茨医科大学的助理教授、资深作者Christian Diener博士说:“总之,这些结果为微生物组介导的精准营养的新途径提供了重要的概念证明。但是,在进入临床实践之前,还有更多的工作要做,以验证这些模型在前瞻性人体试验中的预测能力。”
参考资料
[1] Microbial community-scale metabolic modelling predicts personalized short-chain fatty acid production profiles in the human gut



