摘要:俄亥俄州立大学的神经科学研究人员发现了一种特殊类型的人类白细胞,它具有再生神经纤维的潜力。
在一项新的研究中,俄亥俄州立大学的神经科学研究人员发现了一种特殊类型的人类白细胞,它具有再生神经纤维的潜力。
该研究结果发表在《自然免疫学》杂志上,标志着医学科学的重大飞跃。

图1 NLRC5感知NAD+损耗形成泛视小体并驱动泛视症和炎症
“死亡的神经细胞通常不会被替换,受损的神经纤维通常不会再生,导致永久性的神经功能障碍,”通讯和资深作者Benjamin Segal博士说,他是俄亥俄州立大学韦克斯纳医学中心和医学院神经内科教授和主席。
Segal研究小组发现,骨髓细胞可以转化为强大的治愈剂。通过在实验室用特定分子刺激这些细胞,研究小组能够将它们转化为促进再生的细胞,帮助受损的神经细胞存活和再生。
Segal说:“我们的最终目标是利用这些特殊细胞开发治疗方法,逆转视神经、大脑和脊髓的损伤,从而恢复失去的神经功能。”
长期以来,脊髓、视神经或脑损伤造成的神经损伤,以及ALS、阿尔茨海默氏症和多发性硬化症等退行性神经疾病,一直被认为是永久性的。然而,四年前,西格尔的团队在老鼠身上取得了突破,为数百万受这些疾病影响的人带来了希望。
“我们的新研究表明,患者自己的细胞很可能被用来为这些毁灭性的疾病提供安全有效的治疗,”西格尔研究小组成员、共同第一作者 Andrew Jerome博士说。
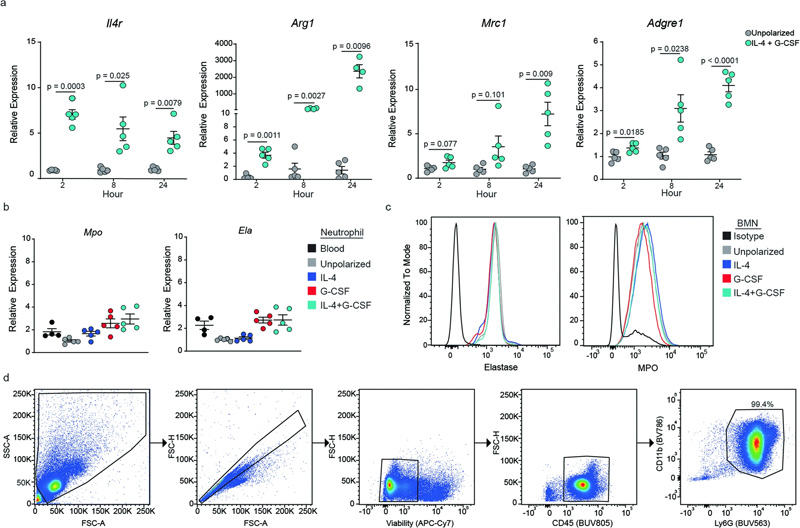
图2 极化过程中BMN基因表达的动力学
在他们最近的研究中,研究小组从八个不同的人类捐赠者的骨髓中产生了促再生细胞。值得注意的是,所有8位捐赠者的细胞都成功地驱使人类神经细胞再生神经纤维。这些细胞甚至使应激神经细胞的存活率增加了三倍。这表明它们可以帮助减缓或预防退行性神经疾病的进展,以及逆转损伤和恢复功能。
“随着这些实验室实验的成功,我们现在的重点转移到将这些新的细胞疗法带给需要它们的患者。“我们相信这些细胞可以从病人身上提取出来,在实验室中刺激并大量生长,然后在损伤或疾病部位重新注入,以再生大脑和脊髓神经纤维”。
Segal团队继续推动这些进步。下一步是开发最有效的方法来培养和输送这些细胞,以便开始临床试验。Segal说,曾经看似不可能的治疗方法现在已经出现。
参考资料
[1] Cytokine polarized, alternatively activated bone marrow neutrophils drive axon regeneration
摘要:俄亥俄州立大学的神经科学研究人员发现了一种特殊类型的人类白细胞,它具有再生神经纤维的潜力。
在一项新的研究中,俄亥俄州立大学的神经科学研究人员发现了一种特殊类型的人类白细胞,它具有再生神经纤维的潜力。
该研究结果发表在《自然免疫学》杂志上,标志着医学科学的重大飞跃。

图1 NLRC5感知NAD+损耗形成泛视小体并驱动泛视症和炎症
“死亡的神经细胞通常不会被替换,受损的神经纤维通常不会再生,导致永久性的神经功能障碍,”通讯和资深作者Benjamin Segal博士说,他是俄亥俄州立大学韦克斯纳医学中心和医学院神经内科教授和主席。
Segal研究小组发现,骨髓细胞可以转化为强大的治愈剂。通过在实验室用特定分子刺激这些细胞,研究小组能够将它们转化为促进再生的细胞,帮助受损的神经细胞存活和再生。
Segal说:“我们的最终目标是利用这些特殊细胞开发治疗方法,逆转视神经、大脑和脊髓的损伤,从而恢复失去的神经功能。”
长期以来,脊髓、视神经或脑损伤造成的神经损伤,以及ALS、阿尔茨海默氏症和多发性硬化症等退行性神经疾病,一直被认为是永久性的。然而,四年前,西格尔的团队在老鼠身上取得了突破,为数百万受这些疾病影响的人带来了希望。
“我们的新研究表明,患者自己的细胞很可能被用来为这些毁灭性的疾病提供安全有效的治疗,”西格尔研究小组成员、共同第一作者 Andrew Jerome博士说。

图2 极化过程中BMN基因表达的动力学
在他们最近的研究中,研究小组从八个不同的人类捐赠者的骨髓中产生了促再生细胞。值得注意的是,所有8位捐赠者的细胞都成功地驱使人类神经细胞再生神经纤维。这些细胞甚至使应激神经细胞的存活率增加了三倍。这表明它们可以帮助减缓或预防退行性神经疾病的进展,以及逆转损伤和恢复功能。
“随着这些实验室实验的成功,我们现在的重点转移到将这些新的细胞疗法带给需要它们的患者。“我们相信这些细胞可以从病人身上提取出来,在实验室中刺激并大量生长,然后在损伤或疾病部位重新注入,以再生大脑和脊髓神经纤维”。
Segal团队继续推动这些进步。下一步是开发最有效的方法来培养和输送这些细胞,以便开始临床试验。Segal说,曾经看似不可能的治疗方法现在已经出现。
参考资料
[1] Cytokine polarized, alternatively activated bone marrow neutrophils drive axon regeneration



