摘要:通过捕获短寿命RNA分子,科学家们可以绘制出基因和控制它们的调控元件之间的关系。
人类基因组包含大约23000个基因,但在任何给定时间,这些基因中只有一小部分在细胞内被激活。控制基因表达的调控元件的复杂网络包括基因组中称为增强子的区域,这些区域通常位于远离它们所调节的基因的地方。
这种距离使得绘制基因和增强子之间复杂的相互作用图谱变得困难。为了克服这个问题,麻省理工学院的研究人员发明了一种新技术,使他们能够观察细胞中基因和增强子激活的时间。当一个基因与一个特定的增强子几乎同时被激活时,它强烈表明该增强子控制着该基因。
在不同类型的细胞中,更多地了解哪些增强子控制哪些基因,可以帮助研究人员确定遗传疾病的潜在药物靶点。基因组研究已经确定了许多与多种疾病有关的非蛋白质编码区域的突变。这些可能是未知的增强剂吗?
“当人们开始使用基因技术来识别具有疾病信息的染色体区域时,大多数这些位点并不对应于基因。我们怀疑它们对应于这些增强子,这些增强子可能离启动子很远,所以能够识别这些增强子是非常重要的,”麻省理工学院名誉教授、麻省理工学院科赫综合癌症研究所成员Phillip Sharp说。
Sharp是今天发表在《Nature》杂志上的这项新研究的资深作者。麻省理工学院研究助理D.B. Jay Mahat是该论文的主要作者。

图1 单细胞新生RNA测序揭示协调的全球转录
寻找eRNA
不到2%的人类基因组是由蛋白质编码基因组成的。基因组的其余部分包括许多控制这些基因何时以及如何表达的元素。增强子被认为是在45年前发现的,它通过与基因启动子区域的物理接触,短暂地形成一个复合物,从而开启基因。
最近,在2010年,研究人员发现这些增强子被转录成RNA分子,称为增强子RNA或eRNA。科学家们怀疑,当增强子与靶基因积极相互作用时,这种转录就会发生。这就提出了一种可能性,即测量eRNA转录水平可以帮助研究人员确定增强子何时活跃,以及它针对哪些基因。
Mahat说:“这些信息对于理解细胞如何发育、理解癌症如何改变它们的调控程序、激活导致去分化和转移性生长的过程非常重要。”
然而,由于eRNA产生的数量非常少,并且在细胞中不能持续很长时间,因此这种绘制已被证明是困难的。此外,eRNA缺乏一种被称为poly-A尾巴的修饰,这是大多数技术用来将RNA从细胞中拉出的“钩子”。
捕获eRNA的一种方法是向细胞中添加一个核苷酸,该核苷酸在与RNA结合时停止转录。这些核苷酸还含有一种叫做生物素的标签,可以用来将RNA从细胞中捞出来。然而,目前的技术只适用于大量细胞,并不能提供单个细胞的信息。
在集思集想捕获eRNA的新方法时,Mahat和Sharp考虑使用点击化学,一种可以将两个分子连接在一起的技术,如果它们每个都被标记上可以一起反应的“点击手柄”。
研究人员设计了一键式手柄标记的核苷酸,一旦这些核苷酸被整合到生长的eRNA链中,这些链就可以用包含互补手柄的标签打捞出来。这使得研究人员能够捕获eRNA,然后对其进行纯化、扩增和测序。每一步都会丢失一些RNA,但Mahat估计他们可以成功地从一个给定的细胞中提取出大约10%的eRNA。
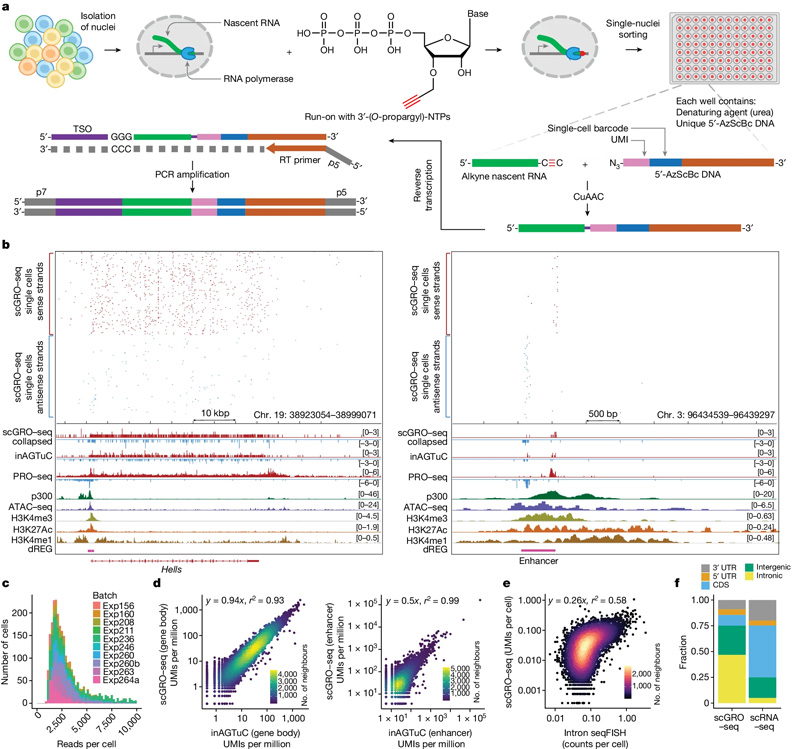
图2 单细胞新生RNA测序的示意图和基准
利用这项技术,研究人员获得了细胞中在给定时间内活跃转录的增强子和基因的快照。
“你希望能够确定,在每个细胞中,从调控元件和相应基因的转录激活。这必须在单个细胞中完成,因为这是你可以检测调节元件和基因之间的同步或异步的地方,”Mahat说。
基因表达的时机
研究人员在小鼠胚胎干细胞中展示了他们的技术,他们发现他们可以根据RNA链的长度和聚合酶(负责转录的酶)的速度——也就是说,聚合酶每秒转录的距离——计算出特定区域开始转录的大致时间。这使他们能够确定哪些基因和增强子在大约同一时间被转录。
研究人员使用这种方法比以前更详细地确定细胞周期基因表达的时间。他们还能够确认几组已知的基因增强子对,并生成了一个大约5万个可能的增强子基因对的列表,他们现在可以尝试验证这些基因对。
了解哪些增强子控制哪些基因,对于开发针对遗传基础疾病的新疗法将证明是有价值的。去年,美国食品和药物管理局(Food and Drug Administration)批准了首个治疗镰状细胞性贫血的基因疗法,该疗法通过干扰一种增强剂来激活胎儿珠蛋白基因,从而减少镰状血细胞的产生。
麻省理工学院的研究小组现在正将这种方法应用于其他类型的细胞,重点是自身免疫性疾病。他们正在与波士顿儿童医院的研究人员合作,探索与狼疮有关的免疫细胞突变,其中许多是在基因组的非编码区域发现的。
“目前还不清楚哪些基因受到这些突变的影响,所以我们开始梳理这些假定的增强子可能调节的基因,以及这些增强子在哪些细胞类型中是活跃的,”Mahat说。“这是一个创建基因到增强子图谱的工具,这是理解生物学的基础,也是理解疾病的基础。”
这项研究的发现也为Sharp最近与麻省理工学院教授理查德·杨和Arup Chakraborty共同提出的一个理论提供了证据,该理论认为基因转录是由被称为冷凝物的无膜液滴控制的。这些凝聚物是由大量的酶和RNA组成的,Sharp认为其中可能包括在增强子位点产生的eRNA。
“我们认为增强子和启动子之间的交流是一种凝聚型的瞬态结构,RNA是其中的一部分。这是一项重要的工作,有助于理解来自增强子的RNA是如何被激活的。
这项研究由美国国家癌症研究所、美国国立卫生研究院和祖母绿基金会博士后过渡奖资助。
参考资料
[1] Single-cell nascent RNA sequencing unveils coordinated global transcription
摘要:通过捕获短寿命RNA分子,科学家们可以绘制出基因和控制它们的调控元件之间的关系。
人类基因组包含大约23000个基因,但在任何给定时间,这些基因中只有一小部分在细胞内被激活。控制基因表达的调控元件的复杂网络包括基因组中称为增强子的区域,这些区域通常位于远离它们所调节的基因的地方。
这种距离使得绘制基因和增强子之间复杂的相互作用图谱变得困难。为了克服这个问题,麻省理工学院的研究人员发明了一种新技术,使他们能够观察细胞中基因和增强子激活的时间。当一个基因与一个特定的增强子几乎同时被激活时,它强烈表明该增强子控制着该基因。
在不同类型的细胞中,更多地了解哪些增强子控制哪些基因,可以帮助研究人员确定遗传疾病的潜在药物靶点。基因组研究已经确定了许多与多种疾病有关的非蛋白质编码区域的突变。这些可能是未知的增强剂吗?
“当人们开始使用基因技术来识别具有疾病信息的染色体区域时,大多数这些位点并不对应于基因。我们怀疑它们对应于这些增强子,这些增强子可能离启动子很远,所以能够识别这些增强子是非常重要的,”麻省理工学院名誉教授、麻省理工学院科赫综合癌症研究所成员Phillip Sharp说。
Sharp是今天发表在《Nature》杂志上的这项新研究的资深作者。麻省理工学院研究助理D.B. Jay Mahat是该论文的主要作者。

图1 单细胞新生RNA测序揭示协调的全球转录
寻找eRNA
不到2%的人类基因组是由蛋白质编码基因组成的。基因组的其余部分包括许多控制这些基因何时以及如何表达的元素。增强子被认为是在45年前发现的,它通过与基因启动子区域的物理接触,短暂地形成一个复合物,从而开启基因。
最近,在2010年,研究人员发现这些增强子被转录成RNA分子,称为增强子RNA或eRNA。科学家们怀疑,当增强子与靶基因积极相互作用时,这种转录就会发生。这就提出了一种可能性,即测量eRNA转录水平可以帮助研究人员确定增强子何时活跃,以及它针对哪些基因。
Mahat说:“这些信息对于理解细胞如何发育、理解癌症如何改变它们的调控程序、激活导致去分化和转移性生长的过程非常重要。”
然而,由于eRNA产生的数量非常少,并且在细胞中不能持续很长时间,因此这种绘制已被证明是困难的。此外,eRNA缺乏一种被称为poly-A尾巴的修饰,这是大多数技术用来将RNA从细胞中拉出的“钩子”。
捕获eRNA的一种方法是向细胞中添加一个核苷酸,该核苷酸在与RNA结合时停止转录。这些核苷酸还含有一种叫做生物素的标签,可以用来将RNA从细胞中捞出来。然而,目前的技术只适用于大量细胞,并不能提供单个细胞的信息。
在集思集想捕获eRNA的新方法时,Mahat和Sharp考虑使用点击化学,一种可以将两个分子连接在一起的技术,如果它们每个都被标记上可以一起反应的“点击手柄”。
研究人员设计了一键式手柄标记的核苷酸,一旦这些核苷酸被整合到生长的eRNA链中,这些链就可以用包含互补手柄的标签打捞出来。这使得研究人员能够捕获eRNA,然后对其进行纯化、扩增和测序。每一步都会丢失一些RNA,但Mahat估计他们可以成功地从一个给定的细胞中提取出大约10%的eRNA。

图2 单细胞新生RNA测序的示意图和基准
利用这项技术,研究人员获得了细胞中在给定时间内活跃转录的增强子和基因的快照。
“你希望能够确定,在每个细胞中,从调控元件和相应基因的转录激活。这必须在单个细胞中完成,因为这是你可以检测调节元件和基因之间的同步或异步的地方,”Mahat说。
基因表达的时机
研究人员在小鼠胚胎干细胞中展示了他们的技术,他们发现他们可以根据RNA链的长度和聚合酶(负责转录的酶)的速度——也就是说,聚合酶每秒转录的距离——计算出特定区域开始转录的大致时间。这使他们能够确定哪些基因和增强子在大约同一时间被转录。
研究人员使用这种方法比以前更详细地确定细胞周期基因表达的时间。他们还能够确认几组已知的基因增强子对,并生成了一个大约5万个可能的增强子基因对的列表,他们现在可以尝试验证这些基因对。
了解哪些增强子控制哪些基因,对于开发针对遗传基础疾病的新疗法将证明是有价值的。去年,美国食品和药物管理局(Food and Drug Administration)批准了首个治疗镰状细胞性贫血的基因疗法,该疗法通过干扰一种增强剂来激活胎儿珠蛋白基因,从而减少镰状血细胞的产生。
麻省理工学院的研究小组现在正将这种方法应用于其他类型的细胞,重点是自身免疫性疾病。他们正在与波士顿儿童医院的研究人员合作,探索与狼疮有关的免疫细胞突变,其中许多是在基因组的非编码区域发现的。
“目前还不清楚哪些基因受到这些突变的影响,所以我们开始梳理这些假定的增强子可能调节的基因,以及这些增强子在哪些细胞类型中是活跃的,”Mahat说。“这是一个创建基因到增强子图谱的工具,这是理解生物学的基础,也是理解疾病的基础。”
这项研究的发现也为Sharp最近与麻省理工学院教授理查德·杨和Arup Chakraborty共同提出的一个理论提供了证据,该理论认为基因转录是由被称为冷凝物的无膜液滴控制的。这些凝聚物是由大量的酶和RNA组成的,Sharp认为其中可能包括在增强子位点产生的eRNA。
“我们认为增强子和启动子之间的交流是一种凝聚型的瞬态结构,RNA是其中的一部分。这是一项重要的工作,有助于理解来自增强子的RNA是如何被激活的。
这项研究由美国国家癌症研究所、美国国立卫生研究院和祖母绿基金会博士后过渡奖资助。
参考资料
[1] Single-cell nascent RNA sequencing unveils coordinated global transcription



