摘要:EPFL科学家的一项新研究提供了一种很有前途的解决方案。
肿瘤细胞经常劫持正常的生理过程来支持它们的生长,利用负责基本细胞功能的蛋白质。因此,重要的是仅在癌细胞中阻断这些蛋白质的活性,而不影响它们在健康组织中的关键作用。出于这个原因,使用小分子诱导全身抑制身体所有细胞的经典方法可能会导致严重的副作用。
被癌细胞劫持的基本蛋白质的一个例子是组织蛋白酶,这是一个酶家族,负责分解其他蛋白质并重塑身体组织。组织蛋白酶与多种癌症、骨质疏松症和自身免疫性疾病有关。然而,小分子组织蛋白酶抑制剂的临床试验由于缺乏疗效或毒性而失败。

图1 抗体-肽偶联物提供共价抑制剂阻断致癌组织蛋白酶
现在,由EPFL的Elisa Oricchio和Bruno Correia领导的一组科学家已经开发出一种新的方法来克服这些限制。他们创建了一个模块化药物平台,将非天然肽抑制剂(nnpi)与抗体偶联,产生抗体-肽抑制剂偶联物(APICs)。这种方法确保了抑制剂被特异性地递送到癌细胞,从而减少了全身副作用,提高了治疗效果。
研究人员首先设计了共价结合并抑制组织蛋白酶的NNPIs。他们修改了肽序列,使其包括一个迈克尔受体,这是一个化学片段,使其更容易与组织蛋白酶形成稳定的结合。
Michael受体与组织蛋白酶活性部位的半胱氨酸残基(负责其主要工作的酶的部分)发生反应,产生稳定的共价连锁,有效地抑制组织蛋白酶。为了进一步优化肽的特异性和效力,研究小组使用了饱和诱变筛选——一种系统地改变蛋白质中的每个氨基酸以找到具有所需特性的最佳变体的方法。
研究人员发现了几种针对四种不同组织蛋白酶的强抑制剂,即组织蛋白酶S、B、K和l。通过将这些抑制剂附着在识别CD22、CD79、HER2和Siglec15的抗体上,研究人员可以精确地将nnpi传递给淋巴瘤细胞、乳腺癌细胞和破骨细胞。这利用了抗体被靶细胞内化的自然能力,精确地将抑制剂定向到需要它们的地方。
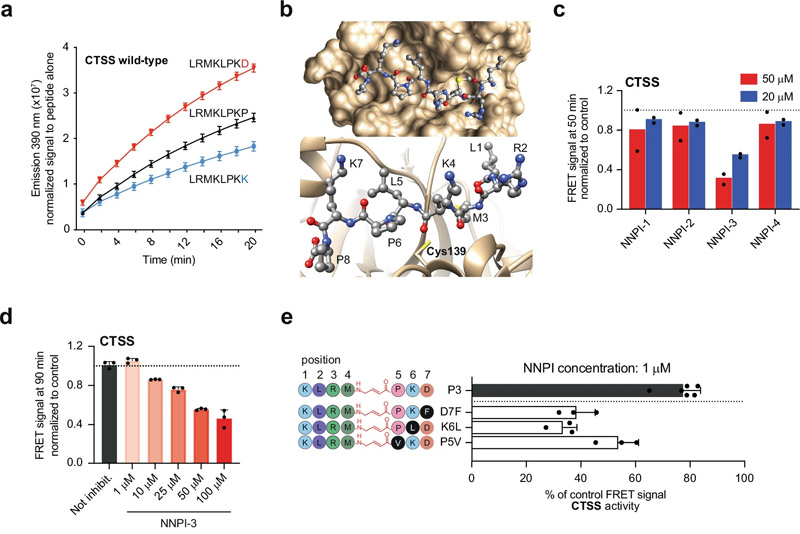
图2 针对CTSS或CTSB的NNPI的设计和开发
然后,是时候测试APICs了:在细胞系和动物模型中,它们都显示出显著的治疗效果。例如,在淋巴瘤模型中,使用靶向组织蛋白酶S的APICs治疗可导致肿瘤缩小并激活针对癌细胞的免疫反应。在乳腺癌模型中,靶向组织蛋白酶B的APICs抑制肿瘤侵袭性和细胞迁移,强调APICs预防转移的潜力。
通过将抑制剂特异性地递送到癌细胞,APIC方法可以避免或最大限度地减少与其他治疗(如化疗)相关的副作用。此外,APIC设计的模块化特性意味着它可以针对与不同疾病有关的各种蛋白酶,这可能会彻底改变癌症以外疾病的治疗前景。
APIC项目现在已经走出了实验室,并迈出了临床现实的第一步。“我们根据这个项目提交了两项专利申请,”Elisa Oricchio说。“Aaron Petruzzella是该项目的博士生,他最近得到了SNF Bridge概念验证奖学金的支持,继续研究这些抑制剂,为创业奠定基础,吸引潜在投资者的注意。”
参考资料
[1] Antibody–peptide conjugates deliver covalent inhibitors blocking oncogenic cathepsins
摘要:EPFL科学家的一项新研究提供了一种很有前途的解决方案。
肿瘤细胞经常劫持正常的生理过程来支持它们的生长,利用负责基本细胞功能的蛋白质。因此,重要的是仅在癌细胞中阻断这些蛋白质的活性,而不影响它们在健康组织中的关键作用。出于这个原因,使用小分子诱导全身抑制身体所有细胞的经典方法可能会导致严重的副作用。
被癌细胞劫持的基本蛋白质的一个例子是组织蛋白酶,这是一个酶家族,负责分解其他蛋白质并重塑身体组织。组织蛋白酶与多种癌症、骨质疏松症和自身免疫性疾病有关。然而,小分子组织蛋白酶抑制剂的临床试验由于缺乏疗效或毒性而失败。

图1 抗体-肽偶联物提供共价抑制剂阻断致癌组织蛋白酶
现在,由EPFL的Elisa Oricchio和Bruno Correia领导的一组科学家已经开发出一种新的方法来克服这些限制。他们创建了一个模块化药物平台,将非天然肽抑制剂(nnpi)与抗体偶联,产生抗体-肽抑制剂偶联物(APICs)。这种方法确保了抑制剂被特异性地递送到癌细胞,从而减少了全身副作用,提高了治疗效果。
研究人员首先设计了共价结合并抑制组织蛋白酶的NNPIs。他们修改了肽序列,使其包括一个迈克尔受体,这是一个化学片段,使其更容易与组织蛋白酶形成稳定的结合。
Michael受体与组织蛋白酶活性部位的半胱氨酸残基(负责其主要工作的酶的部分)发生反应,产生稳定的共价连锁,有效地抑制组织蛋白酶。为了进一步优化肽的特异性和效力,研究小组使用了饱和诱变筛选——一种系统地改变蛋白质中的每个氨基酸以找到具有所需特性的最佳变体的方法。
研究人员发现了几种针对四种不同组织蛋白酶的强抑制剂,即组织蛋白酶S、B、K和l。通过将这些抑制剂附着在识别CD22、CD79、HER2和Siglec15的抗体上,研究人员可以精确地将nnpi传递给淋巴瘤细胞、乳腺癌细胞和破骨细胞。这利用了抗体被靶细胞内化的自然能力,精确地将抑制剂定向到需要它们的地方。

图2 针对CTSS或CTSB的NNPI的设计和开发
然后,是时候测试APICs了:在细胞系和动物模型中,它们都显示出显著的治疗效果。例如,在淋巴瘤模型中,使用靶向组织蛋白酶S的APICs治疗可导致肿瘤缩小并激活针对癌细胞的免疫反应。在乳腺癌模型中,靶向组织蛋白酶B的APICs抑制肿瘤侵袭性和细胞迁移,强调APICs预防转移的潜力。
通过将抑制剂特异性地递送到癌细胞,APIC方法可以避免或最大限度地减少与其他治疗(如化疗)相关的副作用。此外,APIC设计的模块化特性意味着它可以针对与不同疾病有关的各种蛋白酶,这可能会彻底改变癌症以外疾病的治疗前景。
APIC项目现在已经走出了实验室,并迈出了临床现实的第一步。“我们根据这个项目提交了两项专利申请,”Elisa Oricchio说。“Aaron Petruzzella是该项目的博士生,他最近得到了SNF Bridge概念验证奖学金的支持,继续研究这些抑制剂,为创业奠定基础,吸引潜在投资者的注意。”
参考资料
[1] Antibody–peptide conjugates deliver covalent inhibitors blocking oncogenic cathepsins



