摘要:研究团队近日发现,癌症可能源于瞬时的表观遗传变化。
癌症发生和发展通常与体细胞突变的积累有关。然而,蒙彼利埃大学和法国国家科学研究中心(CNRS)领导的研究团队近日发现,癌症可能源于瞬时的表观遗传变化,即使不存在相关的基因突变。
这篇题为“Transient loss of Polycomb components induces an epigenetic cancer fate”的论文于4月24日发表在《Nature》杂志上。

图1 多梳蛋白的瞬时缺失诱发表观遗传性癌症
共同通讯作者、蒙彼利埃大学和法国国家科学研究中心的Giacomo Cavalli表示:“癌症通常被认为是体细胞突变积累的结果,经常涉及到多个突变热点。但某些癌症的驱动突变负荷很低或检测不到。”
此外,之前的研究也暗示,由原发性肿瘤发展而来的转移性肿瘤在没有新的基因改变的情况下也会发生表观遗传改变。
为了探索表观遗传对癌症风险的影响,研究团队对发育中的果蝇幼虫进行了RNA干扰(RNAi)实验,重点研究了一个名为多梳蛋白(Polycomb)的基因沉默复合体,它是表观遗传过程中主要的调控因子,在转录水平抑制下游目标基因的表达。
“在过去十年中,大量的证据表明,许多表观遗传成分在多个类型的癌症中受到干扰,”Cavalli谈道。“在没有DNA驱动突变的情况下,单纯的表观遗传扰动是否能诱发癌症,以及具体的作用机制如何,我们还不清楚。”
利用热敏感RNAi实验可逆性地降低果蝇眼部成虫盘组织中多梳蛋白抑制复合体1(PRC1)的PH亚基后,研究人员发现,在果蝇发育到第三个幼虫阶段时,肿瘤已经形成。
根据幼虫的肿瘤和正常组织样本的全基因组测序分析,肿瘤的形成似乎并不是因为出现了新的基因突变。
作者报告称:“在所有肿瘤样本中,各个基因都未携带有害的变异(SNP或indel),也未携带结构变异或拷贝数变异。”他们认为这些结果及其他结果有力地证明了这些肿瘤中不存在复发性驱动突变。
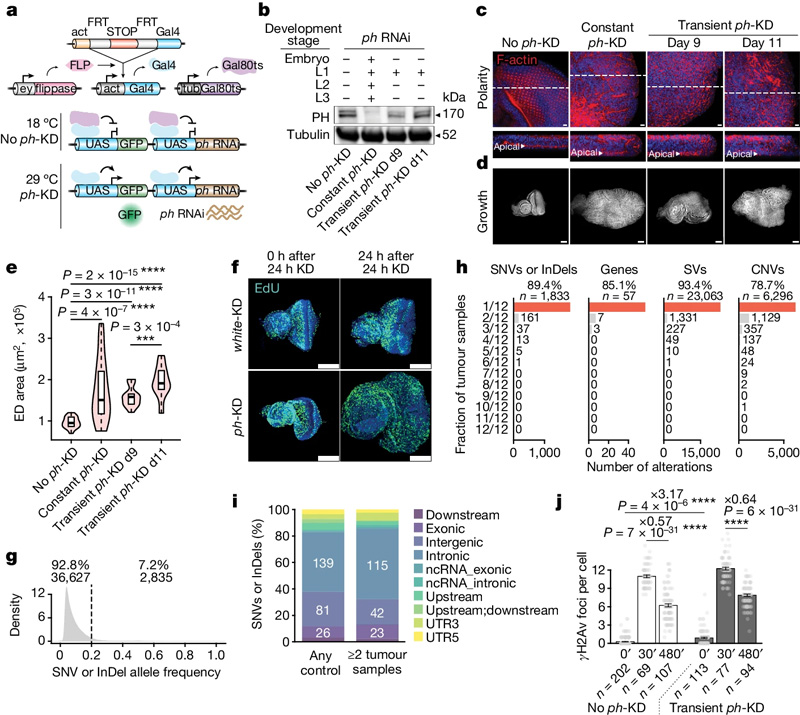
图2 短暂的PRC1耗竭足以引发肿瘤
另一方面,当研究人员利用RNA测序、染色质免疫沉淀测序和ATAC-seq等方法来追踪瞬时敲降PRC1引起的转录组和染色质可及性变化时,他们发现了可逆的表达变化。而在多梳蛋白复合体的活性恢复后,表达改变仍持续存在。
“我们发现,由多梳蛋白复合体介导的转录沉默的瞬时扰动足以诱导果蝇向癌细胞命运的不可逆转换,”作者报告称。
研究人员特别指出,瞬时的多梳蛋白沉默导致果蝇的JAK-STAT信号通路和zfh1基因(ZEB1癌基因的果蝇版)发生不可逆的调控变化,从而导致这些基因去抑制,他们称之为“表观遗传引发的癌症”。
“这些数据表明,在没有驱动基因突变的情况下,多梳蛋白的可逆沉默可引发癌症,”作者写道。“这表明肿瘤可通过表观遗传失调导致细胞命运改变而出现。”
之后,研究人员对已发表的实体瘤和多发性骨髓瘤病例的数据进行分析。他们认为,表观遗传改变可能在人类癌症中产生类似后果,因为PRC1亚基表达水平较低的病例往往表现出较差的生存结局。
Cavalli认为,这些结果最终有望加深研究人员对癌症发展的认识。对于某些突变水平比较低的癌症,这些发现还有助于开发新的治疗策略。
参考资料
[1] Transient loss of Polycomb components induces an epigenetic cancer fate
摘要:研究团队近日发现,癌症可能源于瞬时的表观遗传变化。
癌症发生和发展通常与体细胞突变的积累有关。然而,蒙彼利埃大学和法国国家科学研究中心(CNRS)领导的研究团队近日发现,癌症可能源于瞬时的表观遗传变化,即使不存在相关的基因突变。
这篇题为“Transient loss of Polycomb components induces an epigenetic cancer fate”的论文于4月24日发表在《Nature》杂志上。

图1 多梳蛋白的瞬时缺失诱发表观遗传性癌症
共同通讯作者、蒙彼利埃大学和法国国家科学研究中心的Giacomo Cavalli表示:“癌症通常被认为是体细胞突变积累的结果,经常涉及到多个突变热点。但某些癌症的驱动突变负荷很低或检测不到。”
此外,之前的研究也暗示,由原发性肿瘤发展而来的转移性肿瘤在没有新的基因改变的情况下也会发生表观遗传改变。
为了探索表观遗传对癌症风险的影响,研究团队对发育中的果蝇幼虫进行了RNA干扰(RNAi)实验,重点研究了一个名为多梳蛋白(Polycomb)的基因沉默复合体,它是表观遗传过程中主要的调控因子,在转录水平抑制下游目标基因的表达。
“在过去十年中,大量的证据表明,许多表观遗传成分在多个类型的癌症中受到干扰,”Cavalli谈道。“在没有DNA驱动突变的情况下,单纯的表观遗传扰动是否能诱发癌症,以及具体的作用机制如何,我们还不清楚。”
利用热敏感RNAi实验可逆性地降低果蝇眼部成虫盘组织中多梳蛋白抑制复合体1(PRC1)的PH亚基后,研究人员发现,在果蝇发育到第三个幼虫阶段时,肿瘤已经形成。
根据幼虫的肿瘤和正常组织样本的全基因组测序分析,肿瘤的形成似乎并不是因为出现了新的基因突变。
作者报告称:“在所有肿瘤样本中,各个基因都未携带有害的变异(SNP或indel),也未携带结构变异或拷贝数变异。”他们认为这些结果及其他结果有力地证明了这些肿瘤中不存在复发性驱动突变。

图2 短暂的PRC1耗竭足以引发肿瘤
另一方面,当研究人员利用RNA测序、染色质免疫沉淀测序和ATAC-seq等方法来追踪瞬时敲降PRC1引起的转录组和染色质可及性变化时,他们发现了可逆的表达变化。而在多梳蛋白复合体的活性恢复后,表达改变仍持续存在。
“我们发现,由多梳蛋白复合体介导的转录沉默的瞬时扰动足以诱导果蝇向癌细胞命运的不可逆转换,”作者报告称。
研究人员特别指出,瞬时的多梳蛋白沉默导致果蝇的JAK-STAT信号通路和zfh1基因(ZEB1癌基因的果蝇版)发生不可逆的调控变化,从而导致这些基因去抑制,他们称之为“表观遗传引发的癌症”。
“这些数据表明,在没有驱动基因突变的情况下,多梳蛋白的可逆沉默可引发癌症,”作者写道。“这表明肿瘤可通过表观遗传失调导致细胞命运改变而出现。”
之后,研究人员对已发表的实体瘤和多发性骨髓瘤病例的数据进行分析。他们认为,表观遗传改变可能在人类癌症中产生类似后果,因为PRC1亚基表达水平较低的病例往往表现出较差的生存结局。
Cavalli认为,这些结果最终有望加深研究人员对癌症发展的认识。对于某些突变水平比较低的癌症,这些发现还有助于开发新的治疗策略。
参考资料
[1] Transient loss of Polycomb components induces an epigenetic cancer fate



