摘要:来自日本的研究人员探索了可溶性免疫检查点分子作为预测性生物标志物的潜力。
癌症是一种普遍的疾病,细胞不受控制地分裂和生长,并最终扩散到身体的其他部位或器官。非小细胞肺癌(NSCLC)是一种非常普遍的肺癌。目前针对非小细胞肺癌的治疗策略包括使用免疫检查点抑制剂(ICIs),因为它们为非小细胞肺癌患者提供了显着的临床益处。
ICIs靶向特异性免疫检查点蛋白,如细胞毒性T淋巴细胞相关蛋白-4 (CTLA-4)和/或程序性细胞死亡-1 (PD-1)。肿瘤组织中PD-1配体(PD-L1)的表达(tPD-L1)目前被用作确定非小细胞肺癌患者PD-1或PD-L1靶向治疗疗效的生物标志物。然而,由于tPD-L1表达的异质性和预测价值不足,需要额外的生物标志物。
在此背景下,来自日本的一组研究人员,包括近代大学医学院肿瘤内科的Hidetoshi Hayashi教授和Kazuhiko Nakagawa教授,以及京都大学医学院免疫与基因组医学系的Kenji Chamoto教授和Tasuku Honjo教授,已尝试研究可溶性形式的免疫检查点因子在血浆中测量的化学发光磁技术为基础的自动分析。他们的研究结果发表在2024年4月1日的《The Journal of Clinical Investigation》上。

图1 可溶性免疫检查点因子反映抗肿瘤免疫的耗竭和对PD-1阻断的反应
Hayashi教授分享了他们研究背后的灵感,他说:“诺贝尔医学奖得主Honjo教授建议,使用血液样本而不是肿瘤组织,更动态地了解肿瘤免疫环境是很重要的。”
研究小组评估了PD-1/PD-L1阻断治疗前晚期非小细胞肺癌患者血液样本中免疫检查点分子、PD-L1、PD-1和CTLA-4的可溶性形式。他们对50名接受纳武单抗治疗的患者进行了一项前瞻性试验,被称为“发现队列”。接受PD-1/PD-L1阻断治疗、细胞毒性化疗或靶向治疗等特异性治疗的患者被分为不同的研究队列,统称为“验证队列”,并进行回顾性分析。他们发现,在对PD-1/PD-L1阻断治疗无反应的免疫反应性肿瘤患者中,可溶性免疫检查点因子浓度升高。相比之下,这种相关性在接受细胞毒性化疗或靶向治疗的患者中未见。
此外,对肿瘤大小、肿瘤组织和外周CD8+ T细胞中tPD-L1水平和基因表达的综合分析表明,高水平的可溶性PD-L1、PD-1和CTLA-4与耗尽的抗肿瘤免疫相关。可溶性PD-L1和CTLA-4水平共同能够有效预测热性肿瘤(以各种浸润性免疫细胞高度浸润为特征的肿瘤)NSCLC患者PD-1/PD-L1阻断治疗的疗效。
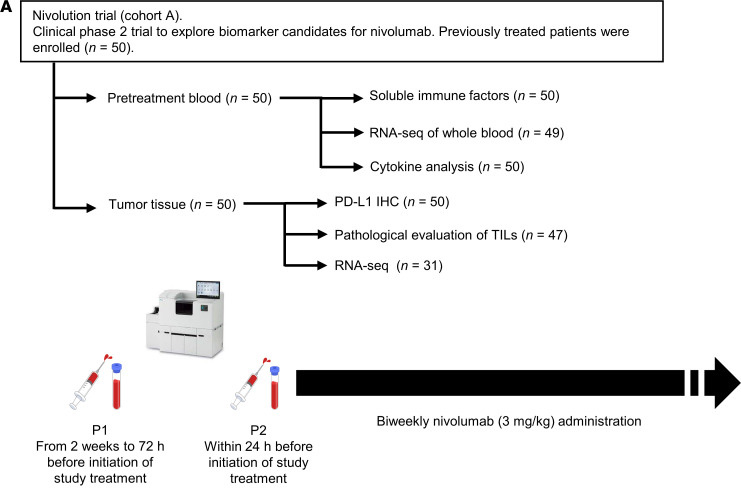
图2 研究中包括的患者队列和分析概述
“基于血液的可溶性标记物可以较少侵入性地识别将从ici中获益更多的患者,同时可能在效果意想不到的情况下提供另一种治疗选择。此外,对晚期非小细胞肺癌患者进行适当的选择性治疗将延长生存率,”Hayashi教授强调了他们的研究工作的潜在现实应用。
因此,血浆中可溶性免疫检查点分子作为生物标志物的鉴定可以为晚期非小细胞肺癌患者更好的治疗结果铺平道路。
参考资料
[1] Soluble immune checkpoint factors reflect exhaustion of antitumor immunity and response to PD-1 blockade
摘要:来自日本的研究人员探索了可溶性免疫检查点分子作为预测性生物标志物的潜力。
癌症是一种普遍的疾病,细胞不受控制地分裂和生长,并最终扩散到身体的其他部位或器官。非小细胞肺癌(NSCLC)是一种非常普遍的肺癌。目前针对非小细胞肺癌的治疗策略包括使用免疫检查点抑制剂(ICIs),因为它们为非小细胞肺癌患者提供了显着的临床益处。
ICIs靶向特异性免疫检查点蛋白,如细胞毒性T淋巴细胞相关蛋白-4 (CTLA-4)和/或程序性细胞死亡-1 (PD-1)。肿瘤组织中PD-1配体(PD-L1)的表达(tPD-L1)目前被用作确定非小细胞肺癌患者PD-1或PD-L1靶向治疗疗效的生物标志物。然而,由于tPD-L1表达的异质性和预测价值不足,需要额外的生物标志物。
在此背景下,来自日本的一组研究人员,包括近代大学医学院肿瘤内科的Hidetoshi Hayashi教授和Kazuhiko Nakagawa教授,以及京都大学医学院免疫与基因组医学系的Kenji Chamoto教授和Tasuku Honjo教授,已尝试研究可溶性形式的免疫检查点因子在血浆中测量的化学发光磁技术为基础的自动分析。他们的研究结果发表在2024年4月1日的《The Journal of Clinical Investigation》上。

图1 可溶性免疫检查点因子反映抗肿瘤免疫的耗竭和对PD-1阻断的反应
Hayashi教授分享了他们研究背后的灵感,他说:“诺贝尔医学奖得主Honjo教授建议,使用血液样本而不是肿瘤组织,更动态地了解肿瘤免疫环境是很重要的。”
研究小组评估了PD-1/PD-L1阻断治疗前晚期非小细胞肺癌患者血液样本中免疫检查点分子、PD-L1、PD-1和CTLA-4的可溶性形式。他们对50名接受纳武单抗治疗的患者进行了一项前瞻性试验,被称为“发现队列”。接受PD-1/PD-L1阻断治疗、细胞毒性化疗或靶向治疗等特异性治疗的患者被分为不同的研究队列,统称为“验证队列”,并进行回顾性分析。他们发现,在对PD-1/PD-L1阻断治疗无反应的免疫反应性肿瘤患者中,可溶性免疫检查点因子浓度升高。相比之下,这种相关性在接受细胞毒性化疗或靶向治疗的患者中未见。
此外,对肿瘤大小、肿瘤组织和外周CD8+ T细胞中tPD-L1水平和基因表达的综合分析表明,高水平的可溶性PD-L1、PD-1和CTLA-4与耗尽的抗肿瘤免疫相关。可溶性PD-L1和CTLA-4水平共同能够有效预测热性肿瘤(以各种浸润性免疫细胞高度浸润为特征的肿瘤)NSCLC患者PD-1/PD-L1阻断治疗的疗效。

图2 研究中包括的患者队列和分析概述
“基于血液的可溶性标记物可以较少侵入性地识别将从ici中获益更多的患者,同时可能在效果意想不到的情况下提供另一种治疗选择。此外,对晚期非小细胞肺癌患者进行适当的选择性治疗将延长生存率,”Hayashi教授强调了他们的研究工作的潜在现实应用。
因此,血浆中可溶性免疫检查点分子作为生物标志物的鉴定可以为晚期非小细胞肺癌患者更好的治疗结果铺平道路。
参考资料
[1] Soluble immune checkpoint factors reflect exhaustion of antitumor immunity and response to PD-1 blockade



