摘要:阿尔伯特·爱因斯坦医学院的科学家们发现,如果没有DNA损伤和脑部炎症,就无法形成长期记忆。
正如不打破鸡蛋就做不出煎蛋卷一样,阿尔伯特·爱因斯坦医学院的科学家们发现,如果没有DNA损伤和脑部炎症,就无法形成长期记忆。他们令人惊讶的发现今天发表在《自然》杂志的网络版上。
研究负责人、神经科学教授Jelena Radulovic说:“大脑神经元的炎症通常被认为是一件坏事,因为它会导致神经系统问题,如阿尔茨海默氏症和帕金森病,但我们的研究结果表明,大脑海马区某些神经元的炎症对于形成持久记忆至关重要。”

图1 通过DNA感应TLR9途径形成记忆组件
海马体一直被认为是大脑的记忆中心。Radulovic博士和她的同事们发现,刺激会在某些海马神经元中引发DNA损伤和修复的循环,从而形成稳定的记忆集合——代表我们过去经历的脑细胞群。
文章一作为Elizabeth Wood和博士后Ana Cicvaric。
从冲击到稳定记忆
研究人员通过对小鼠进行短暂、轻微的冲击,使其对冲击事件形成记忆(情景记忆,episodic memory,生物通注),从而发现了这种记忆形成机制。然后,他们分析了海马区的神经元,发现参与重要炎症信号通路的基因被激活了。
“我们观察到toll样受体9 (TLR9)通路中涉及的基因的强烈激活,这种炎症途径最著名的是通过检测病原体DNA的小片段来触发免疫反应。所以一开始我们假设TLR9通路被激活是因为小鼠被感染了。但更仔细地观察,我们惊奇地发现,TLR9只在显示DNA损伤的海马细胞群中被激活。”Radulovic博士说。
大脑活动通常会引起DNA发生小的断裂,并在几分钟内修复。但在这群海马体神经元中,DNA损伤似乎更严重、更持久。
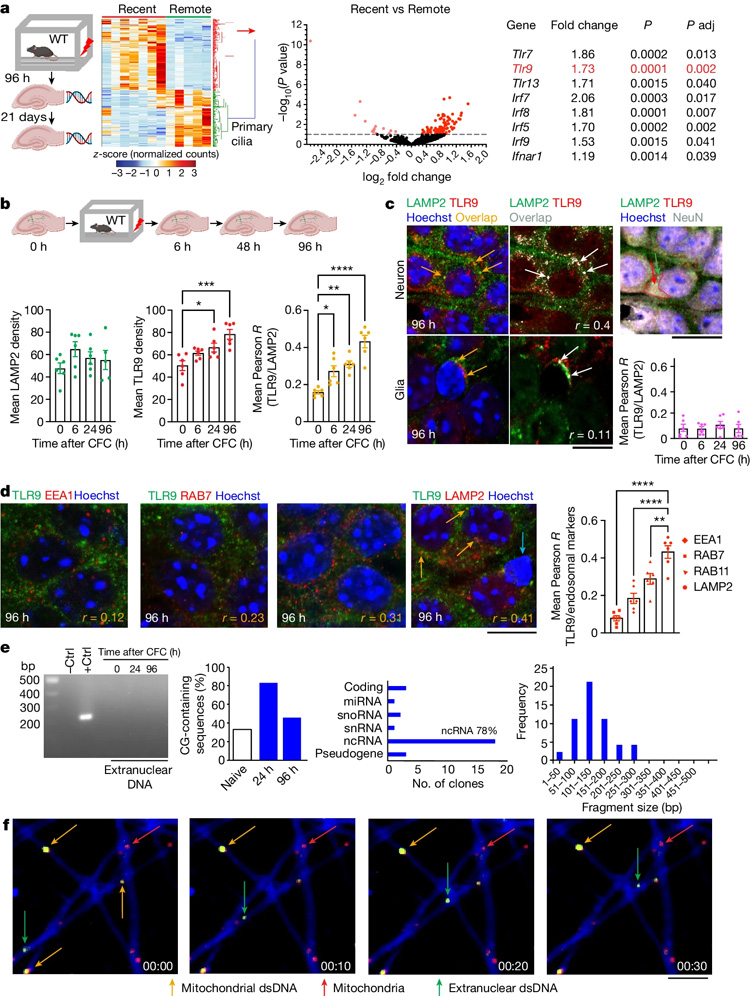
图2 CFC后的核酸传感活性
引发炎症,制造记忆
进一步的分析表明,DNA碎片以及DNA损伤产生的其他分子从细胞核中释放出来,之后神经元的TLR9炎症通路被激活;这一途径反过来刺激DNA修复复合物在一个不寻常的位置形成:中心体。这些细胞器存在于大多数动物细胞的细胞质中,对协调细胞分裂至关重要。但在不分裂的神经元中,受刺激的中心体参与了DNA修复的循环,似乎将单个神经元组织成记忆集合。
“数百万年来,细胞分裂和免疫反应在动物生命中一直高度保守,使生命得以延续,同时为外来病原体提供保护,在进化过程中,海马神经元似乎采用了这种基于免疫的记忆机制,将免疫反应的DNA感应TLR9途径与DNA修复中心体功能结合起来,在不进行细胞分裂的情况下形成记忆。”
抵制外来信息的输入
在完成炎症过程所需的一周内,研究人员发现小鼠记忆编码神经元以各种方式发生了变化,包括对新的或类似的环境刺激变得更有抵抗力。
“这是值得注意的,因为我们不断被信息淹没,而编码记忆的神经元需要保存它们已经获得的信息,而不是被新的输入‘分散’。”
重要的是,研究人员发现,阻断海马神经元中的TLR9炎症通路不仅会阻止小鼠形成长期记忆,还会导致严重的基因组不稳定,即这些神经元中DNA损伤的频率很高。
“基因组不稳定被认为是加速衰老、癌症、精神和神经退行性疾病(如阿尔茨海默氏症)的标志,已经提出了抑制TLR9途径的药物来缓解长冠状病毒的症状。但需要谨慎,因为完全抑制TLR9通路可能会带来重大的健康风险。”Radulovic博士说。
Weissman的团队正在研究一种类似的方法来重新平衡老化的人类血液干细胞。但他说,即使假设有充足的资金,没有意外的挫折,他们也至少需要三到五年才能开始在人身上进行测试。
与此同时,他的团队将继续对小鼠进行研究,以进一步了解抗体疗法的其他效果,比如它是否会影响癌症或炎症性疾病的发病率。“老年人和年轻人的造血系统有很大的不同,”Weissman说。“这不仅仅是骨髓的不同。全身都不一样。”
参考资料
[1] Formation of memory assemblies through the DNA-sensing TLR9 pathway
摘要:阿尔伯特·爱因斯坦医学院的科学家们发现,如果没有DNA损伤和脑部炎症,就无法形成长期记忆。
正如不打破鸡蛋就做不出煎蛋卷一样,阿尔伯特·爱因斯坦医学院的科学家们发现,如果没有DNA损伤和脑部炎症,就无法形成长期记忆。他们令人惊讶的发现今天发表在《自然》杂志的网络版上。
研究负责人、神经科学教授Jelena Radulovic说:“大脑神经元的炎症通常被认为是一件坏事,因为它会导致神经系统问题,如阿尔茨海默氏症和帕金森病,但我们的研究结果表明,大脑海马区某些神经元的炎症对于形成持久记忆至关重要。”

图1 通过DNA感应TLR9途径形成记忆组件
海马体一直被认为是大脑的记忆中心。Radulovic博士和她的同事们发现,刺激会在某些海马神经元中引发DNA损伤和修复的循环,从而形成稳定的记忆集合——代表我们过去经历的脑细胞群。
文章一作为Elizabeth Wood和博士后Ana Cicvaric。
从冲击到稳定记忆
研究人员通过对小鼠进行短暂、轻微的冲击,使其对冲击事件形成记忆(情景记忆,episodic memory,生物通注),从而发现了这种记忆形成机制。然后,他们分析了海马区的神经元,发现参与重要炎症信号通路的基因被激活了。
“我们观察到toll样受体9 (TLR9)通路中涉及的基因的强烈激活,这种炎症途径最著名的是通过检测病原体DNA的小片段来触发免疫反应。所以一开始我们假设TLR9通路被激活是因为小鼠被感染了。但更仔细地观察,我们惊奇地发现,TLR9只在显示DNA损伤的海马细胞群中被激活。”Radulovic博士说。
大脑活动通常会引起DNA发生小的断裂,并在几分钟内修复。但在这群海马体神经元中,DNA损伤似乎更严重、更持久。

图2 CFC后的核酸传感活性
引发炎症,制造记忆
进一步的分析表明,DNA碎片以及DNA损伤产生的其他分子从细胞核中释放出来,之后神经元的TLR9炎症通路被激活;这一途径反过来刺激DNA修复复合物在一个不寻常的位置形成:中心体。这些细胞器存在于大多数动物细胞的细胞质中,对协调细胞分裂至关重要。但在不分裂的神经元中,受刺激的中心体参与了DNA修复的循环,似乎将单个神经元组织成记忆集合。
“数百万年来,细胞分裂和免疫反应在动物生命中一直高度保守,使生命得以延续,同时为外来病原体提供保护,在进化过程中,海马神经元似乎采用了这种基于免疫的记忆机制,将免疫反应的DNA感应TLR9途径与DNA修复中心体功能结合起来,在不进行细胞分裂的情况下形成记忆。”
抵制外来信息的输入
在完成炎症过程所需的一周内,研究人员发现小鼠记忆编码神经元以各种方式发生了变化,包括对新的或类似的环境刺激变得更有抵抗力。
“这是值得注意的,因为我们不断被信息淹没,而编码记忆的神经元需要保存它们已经获得的信息,而不是被新的输入‘分散’。”
重要的是,研究人员发现,阻断海马神经元中的TLR9炎症通路不仅会阻止小鼠形成长期记忆,还会导致严重的基因组不稳定,即这些神经元中DNA损伤的频率很高。
“基因组不稳定被认为是加速衰老、癌症、精神和神经退行性疾病(如阿尔茨海默氏症)的标志,已经提出了抑制TLR9途径的药物来缓解长冠状病毒的症状。但需要谨慎,因为完全抑制TLR9通路可能会带来重大的健康风险。”Radulovic博士说。
Weissman的团队正在研究一种类似的方法来重新平衡老化的人类血液干细胞。但他说,即使假设有充足的资金,没有意外的挫折,他们也至少需要三到五年才能开始在人身上进行测试。
与此同时,他的团队将继续对小鼠进行研究,以进一步了解抗体疗法的其他效果,比如它是否会影响癌症或炎症性疾病的发病率。“老年人和年轻人的造血系统有很大的不同,”Weissman说。“这不仅仅是骨髓的不同。全身都不一样。”
参考资料
[1] Formation of memory assemblies through the DNA-sensing TLR9 pathway



