摘要:新研究表明,用光和声音刺激关键的大脑节律可以增加中间神经元的肽释放。
麻省理工学院和其他地方的研究正在提供越来越多的证据,证明在40赫兹的伽马脑节律频率下,光的闪烁和声音的滴答声可以减少阿尔茨海默病(AD)的进展,并治疗人类志愿者和实验室老鼠的症状。在《自然》杂志上的一项新研究中,麻省理工学院Picower学习和记忆研究所的研究人员利用该疾病的小鼠模型揭示了一个可能有助于这些有益效果的关键机制:淀粉样蛋白的清除,AD病理的标志,通过大脑的淋巴系统,一个最近发现的与大脑血管平行的“管道”网络。

图1 多传感器伽玛刺激促进淋巴结清除淀粉样蛋白
“自从我们在2016年公布了第一批结果以来,人们一直问我它是如何工作的?为什么是40赫兹?为什么不是其他的频率呢? 这些确实是我们在实验室里非常努力地解决的非常重要的问题。”该研究的资深作者Li-Huei Tsai说。
这篇新论文来自第一作者Mitch Murdock还是麻省理工学院(MIT)大脑与认知科学的博士生时的研究。实验表明,当感觉伽马刺激增加小鼠大脑中40赫兹的功率和同步性时,会促使一种特定类型的神经元释放肽。研究结果进一步表明,这些短蛋白信号随后驱动特定的过程,通过淋巴系统促进淀粉样蛋白的清除。
“我们还没有一个事件发生的确切顺序的线性图,但我们的实验结果支持这种通过主要淋巴途径清除的途径。”Murdock说。
从伽玛到淋巴细胞
因为先前的研究表明,淋巴系统是脑废物清除的关键通道,可能受到脑节律的调节,Tsai和Murdock的团队假设,这可能有助于解释实验室先前观察到的伽马感觉刺激降低了阿尔茨海默氏症模型小鼠的淀粉样蛋白水平。
Murdock等人用“5XFAD”小鼠进行实验,这种小鼠是阿尔茨海默氏症的基因模型,他们首先复制了实验室之前的结果,即40赫兹的感官刺激增加了大脑中40赫兹的神经元活动,降低了淀粉样蛋白水平。然后,他们开始测量通过淋巴系统携带废物的液体是否有任何相关的变化。事实上,他们测量了与未治疗的对照组相比,接受感觉伽马刺激的小鼠脑组织中脑脊液的增加。他们还测量了脑组织间质液流出率的增加。此外,在接受伽玛治疗的小鼠中,他测量了排泄液体的淋巴管直径的增加,并测量了颈淋巴结中淀粉样蛋白积累的增加,颈淋巴结是血液流动的排泄部位。
为了研究这种增加的液体流动是如何发生的,研究小组把重点放在了星形胶质细胞的水通道蛋白4 (AQP4)上,它使细胞能够促进淋巴液体交换。当他们用一种化学物质阻断APQ4的功能时,就会阻止感觉刺激降低淀粉样蛋白水平,从而阻止它改善小鼠的学习和记忆能力。作为一项额外的测试,他们使用了一种基因技术来破坏AQP4,这也干扰了γ驱动的淀粉样蛋白清除。
除了星形胶质细胞中APQ4活性促进的液体交换外,伽马波促进淋巴流动的另一种机制是通过增加邻近血管的脉动。几项测量显示,与未治疗的对照组相比,受到感觉伽马刺激的小鼠动脉搏动更强。
跟踪一种情况(如感觉伽马刺激)如何影响不同细胞类型的最好的新技术之一是对它们的RNA进行测序,以跟踪它们如何表达基因的变化。使用这种方法,Tsai和Murdock的团队发现伽马感觉刺激确实促进了与星形胶质细胞AQP4活性增加一致的变化。
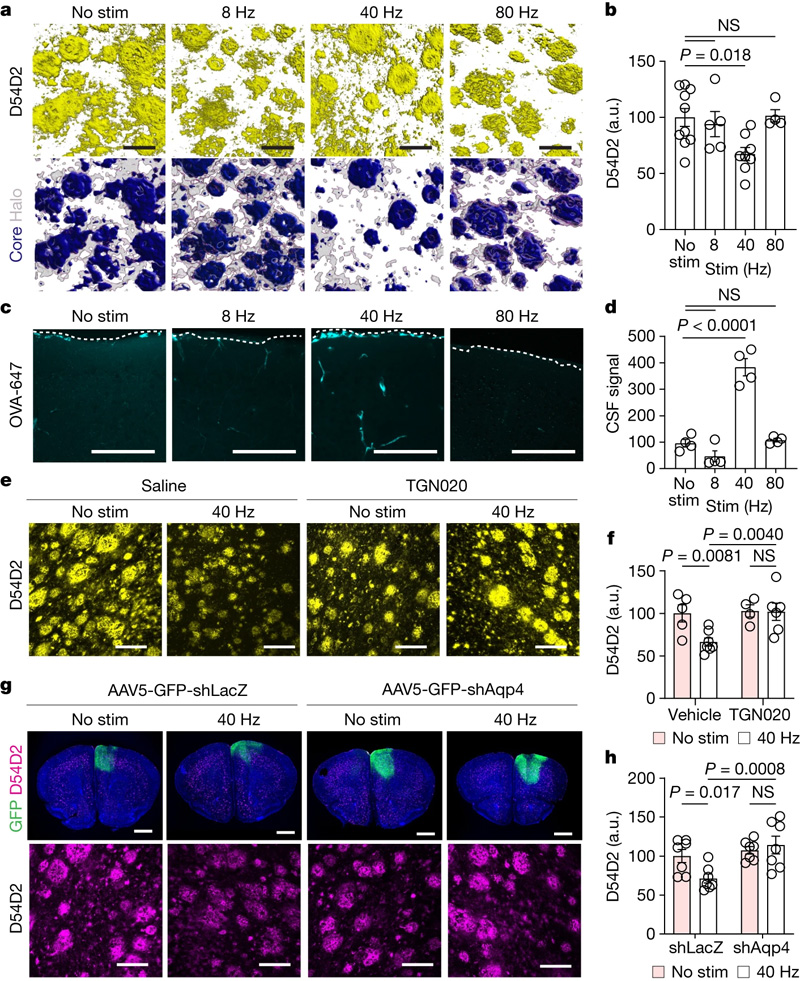
图2 40 Hz多传感器刺激促进AQP4依赖性清除淀粉样蛋白
多肽刺激
他们的研究表明,通过蛋白质摄入超过22%的日常饮食热量会对负责清除细胞碎片的巨噬细胞产生负面影响,导致这些细胞在血管壁内堆积成“墓地”,并随着时间的推移恶化动脉粥样硬化斑块。有趣的是,对循环氨基酸的分析表明,亮氨酸——一种在牛肉、鸡蛋和牛奶等动物源性食物中富含的氨基酸——是异常巨噬细胞激活和动脉粥样硬化风险的主要原因,这表明了个性化饮食调整或“精确营养”的进一步研究的潜在途径。
导航蛋白质消费和心血管健康
RNA测序数据还显示,在伽马感觉刺激下,神经元的一个子集,称为“中间神经元”,在几种肽的产生上经历了显著的上升。这并不奇怪,因为已知肽的释放依赖于脑节律频率,但它仍然值得注意,因为一种特殊的肽,VIP,与阿尔茨海默氏症的对抗有益,并有助于调节血管细胞,血液流动和淋巴清除。
抓住这个有趣的结果,研究小组进行了测试,发现伽马治疗小鼠大脑中的VIP增加了。研究人员还使用了肽释放传感器,观察到感觉伽马刺激导致表达vip的中间神经元的肽释放增加。
但是这种γ刺激的肽释放是否介导了淀粉样蛋白的淋巴清除?为了找到答案,研究小组进行了另一项实验:他们用化学方法关闭VIP神经元。当他们这样做时,然后将小鼠暴露在感官伽马刺激下,他们发现动脉搏动不再增加,伽马刺激的淀粉样蛋白也不再清除。
“我们认为有许多神经肽参与其中,”Murdock说。Tsai补充说,实验室研究的一个主要新方向将是确定哪些肽或其他分子因素可能由感觉伽马刺激驱动。
Tsai和Murdock补充说,虽然这篇论文关注的可能是一个重要的机制-淀粉样蛋白的淋巴清除-通过感觉伽马刺激帮助大脑,但它可能不是唯一重要的潜在机制。在这项研究中显示的清除效果发生得相当快,但在实验室实验和临床研究中,需要数周或数月的慢性感觉伽马刺激才能对认知产生持续的影响。
然而,随着每一项新的研究,科学家们对大脑节律的感官刺激如何有助于治疗神经系统疾病有了更多的了解。
参考资料
[1] Multisensory gamma stimulation promotes glymphatic clearance of amyloid
摘要:新研究表明,用光和声音刺激关键的大脑节律可以增加中间神经元的肽释放。
麻省理工学院和其他地方的研究正在提供越来越多的证据,证明在40赫兹的伽马脑节律频率下,光的闪烁和声音的滴答声可以减少阿尔茨海默病(AD)的进展,并治疗人类志愿者和实验室老鼠的症状。在《自然》杂志上的一项新研究中,麻省理工学院Picower学习和记忆研究所的研究人员利用该疾病的小鼠模型揭示了一个可能有助于这些有益效果的关键机制:淀粉样蛋白的清除,AD病理的标志,通过大脑的淋巴系统,一个最近发现的与大脑血管平行的“管道”网络。

图1 多传感器伽玛刺激促进淋巴结清除淀粉样蛋白
“自从我们在2016年公布了第一批结果以来,人们一直问我它是如何工作的?为什么是40赫兹?为什么不是其他的频率呢? 这些确实是我们在实验室里非常努力地解决的非常重要的问题。”该研究的资深作者Li-Huei Tsai说。
这篇新论文来自第一作者Mitch Murdock还是麻省理工学院(MIT)大脑与认知科学的博士生时的研究。实验表明,当感觉伽马刺激增加小鼠大脑中40赫兹的功率和同步性时,会促使一种特定类型的神经元释放肽。研究结果进一步表明,这些短蛋白信号随后驱动特定的过程,通过淋巴系统促进淀粉样蛋白的清除。
“我们还没有一个事件发生的确切顺序的线性图,但我们的实验结果支持这种通过主要淋巴途径清除的途径。”Murdock说。
从伽玛到淋巴细胞
因为先前的研究表明,淋巴系统是脑废物清除的关键通道,可能受到脑节律的调节,Tsai和Murdock的团队假设,这可能有助于解释实验室先前观察到的伽马感觉刺激降低了阿尔茨海默氏症模型小鼠的淀粉样蛋白水平。
Murdock等人用“5XFAD”小鼠进行实验,这种小鼠是阿尔茨海默氏症的基因模型,他们首先复制了实验室之前的结果,即40赫兹的感官刺激增加了大脑中40赫兹的神经元活动,降低了淀粉样蛋白水平。然后,他们开始测量通过淋巴系统携带废物的液体是否有任何相关的变化。事实上,他们测量了与未治疗的对照组相比,接受感觉伽马刺激的小鼠脑组织中脑脊液的增加。他们还测量了脑组织间质液流出率的增加。此外,在接受伽玛治疗的小鼠中,他测量了排泄液体的淋巴管直径的增加,并测量了颈淋巴结中淀粉样蛋白积累的增加,颈淋巴结是血液流动的排泄部位。
为了研究这种增加的液体流动是如何发生的,研究小组把重点放在了星形胶质细胞的水通道蛋白4 (AQP4)上,它使细胞能够促进淋巴液体交换。当他们用一种化学物质阻断APQ4的功能时,就会阻止感觉刺激降低淀粉样蛋白水平,从而阻止它改善小鼠的学习和记忆能力。作为一项额外的测试,他们使用了一种基因技术来破坏AQP4,这也干扰了γ驱动的淀粉样蛋白清除。
除了星形胶质细胞中APQ4活性促进的液体交换外,伽马波促进淋巴流动的另一种机制是通过增加邻近血管的脉动。几项测量显示,与未治疗的对照组相比,受到感觉伽马刺激的小鼠动脉搏动更强。
跟踪一种情况(如感觉伽马刺激)如何影响不同细胞类型的最好的新技术之一是对它们的RNA进行测序,以跟踪它们如何表达基因的变化。使用这种方法,Tsai和Murdock的团队发现伽马感觉刺激确实促进了与星形胶质细胞AQP4活性增加一致的变化。

图2 40 Hz多传感器刺激促进AQP4依赖性清除淀粉样蛋白
多肽刺激
他们的研究表明,通过蛋白质摄入超过22%的日常饮食热量会对负责清除细胞碎片的巨噬细胞产生负面影响,导致这些细胞在血管壁内堆积成“墓地”,并随着时间的推移恶化动脉粥样硬化斑块。有趣的是,对循环氨基酸的分析表明,亮氨酸——一种在牛肉、鸡蛋和牛奶等动物源性食物中富含的氨基酸——是异常巨噬细胞激活和动脉粥样硬化风险的主要原因,这表明了个性化饮食调整或“精确营养”的进一步研究的潜在途径。
导航蛋白质消费和心血管健康
RNA测序数据还显示,在伽马感觉刺激下,神经元的一个子集,称为“中间神经元”,在几种肽的产生上经历了显著的上升。这并不奇怪,因为已知肽的释放依赖于脑节律频率,但它仍然值得注意,因为一种特殊的肽,VIP,与阿尔茨海默氏症的对抗有益,并有助于调节血管细胞,血液流动和淋巴清除。
抓住这个有趣的结果,研究小组进行了测试,发现伽马治疗小鼠大脑中的VIP增加了。研究人员还使用了肽释放传感器,观察到感觉伽马刺激导致表达vip的中间神经元的肽释放增加。
但是这种γ刺激的肽释放是否介导了淀粉样蛋白的淋巴清除?为了找到答案,研究小组进行了另一项实验:他们用化学方法关闭VIP神经元。当他们这样做时,然后将小鼠暴露在感官伽马刺激下,他们发现动脉搏动不再增加,伽马刺激的淀粉样蛋白也不再清除。
“我们认为有许多神经肽参与其中,”Murdock说。Tsai补充说,实验室研究的一个主要新方向将是确定哪些肽或其他分子因素可能由感觉伽马刺激驱动。
Tsai和Murdock补充说,虽然这篇论文关注的可能是一个重要的机制-淀粉样蛋白的淋巴清除-通过感觉伽马刺激帮助大脑,但它可能不是唯一重要的潜在机制。在这项研究中显示的清除效果发生得相当快,但在实验室实验和临床研究中,需要数周或数月的慢性感觉伽马刺激才能对认知产生持续的影响。
然而,随着每一项新的研究,科学家们对大脑节律的感官刺激如何有助于治疗神经系统疾病有了更多的了解。
参考资料
[1] Multisensory gamma stimulation promotes glymphatic clearance of amyloid



