摘要:苏黎世大学的科学家们开发了一种创新的神经细胞培养模型,揭示了神经变性背后的复杂机制。
苏黎世大学的科学家们开发了一种创新的神经细胞培养模型,揭示了神经变性背后的复杂机制。他们的研究确定了一种错误的蛋白质,作为治疗肌萎缩侧索硬化症(ALS)和额颞叶痴呆(FTD)的有希望的治疗靶点。
神经退行性疾病导致我们大脑中的一些神经元死亡,根据受影响的大脑区域导致不同的症状。在肌萎缩性侧索硬化症(ALS)中,运动皮层和脊髓中的神经元退化,导致瘫痪。另一方面,在额颞叶痴呆(FTD)中,位于大脑中与认知、语言和人格有关的部分的神经元受到影响。

图1 人类神经网络模型揭示ALS和FTLD中的NPTX2病理
ALS和FTD都是不断发展的疾病,仍然缺乏有效的治疗方法。随着人口老龄化,与年龄相关的神经退行性疾病,如ALS和FTD的患病率预计将增加。
尽管在中枢神经系统神经元中发现了一种名为TDP-43的蛋白质的异常积累,这是绝大多数ALS和约一半的FTD患者的共同因素,但驱动神经退行性变的潜在细胞机制在很大程度上仍然未知。
灵活,耐用,可重复性:ALS和FTD研究的理想细胞培养模型
在他们的研究中,苏黎世大学定量生物医学院的第一作者Marian Hruska-Plochan和通讯作者Magdalini Polymenidou开发了一种新的神经细胞培养模型,该模型复制了神经元中TDP-43的异常行为。利用这个模型,他们发现NPTX2蛋白的毒性增加,表明它是ALS和FTD的潜在治疗靶点。
为了模拟神经退化,Marian Hruska-Plochan开发了一种新的细胞培养模型,称为“iNets”,来源于人类诱导多能干细胞。这些细胞起源于皮肤细胞,并在实验室中被重新编程到非常早期的未分化阶段,作为发展许多不同的,期望的细胞类型的来源。神经网络是由相互连接的神经元和它们的支持细胞组成的网络,这些细胞在培养皿中生长成多层。
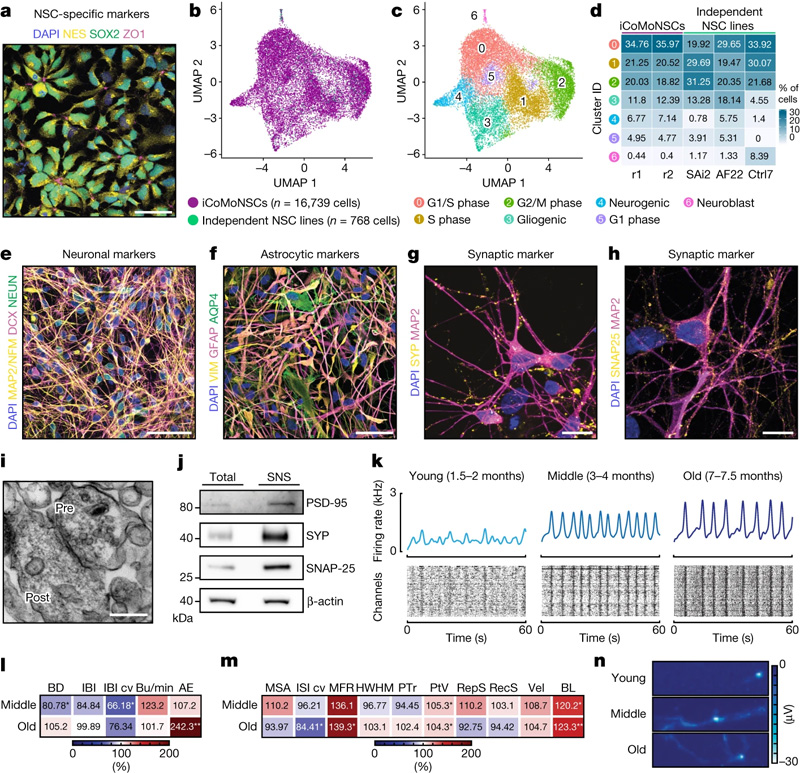
图2 iCoMoNSC神经元形成功能网络
这种培养持续的时间特别长——长达一年——而且很容易繁殖。“老化的神经网络的健壮性使我们能够进行原本不可能进行的实验,”Hruska-Plochan说。“该模型的灵活性使其适用于各种实验方法。”作为一个恰当的例子,iNets细胞培养为研究TDP-43功能障碍到神经退行性变的进展提供了理想的模型。
蛋白质功能障碍如何导致神经退行性变
利用inet模型,研究人员发现了NPTX2的毒性积累,这是一种通常由神经元通过突触分泌的蛋白质,是TDP-43行为不当和神经元死亡之间缺失的一环。为了验证他们的假设,他们检查了已故ALS和FTD患者的脑组织,确实发现,同样在患者中,NPTX2积聚在含有异常TDP-43的细胞中。这意味着iNets培养模型准确地预测了ALS和FTD患者的病理。
在inet模型的其他实验中,研究人员测试了NPTX2是否可以成为治疗ALS和FTD的药物设计的靶点。该团队设计了一个设置,当神经元遭受TDP-43行为不当时,他们降低了NPTX2的水平。他们发现,保持低水平的NPTX2可以抵消iNets神经元的神经变性。因此,减少NPTX2蛋白含量的药物有可能成为阻止ALS和FTD患者神经退行性变的治疗策略。
Magdalini Polymenidou看到了这一发现的巨大希望:“在将其应用于患者之前,我们还有很长的路要走,但NPTX2的发现给了我们一个明确的目标,即开发一种针对疾病核心的治疗方法,”她说。她补充说:“结合其他研究小组最近确定的另外两个靶点,可以想象,抗nptx2药物可能在未来成为ALS和FTD联合治疗的关键组成部分。”
参考资料
[1] A model of human neural networks reveals NPTX2 pathology in ALS and FTLD
摘要:苏黎世大学的科学家们开发了一种创新的神经细胞培养模型,揭示了神经变性背后的复杂机制。
苏黎世大学的科学家们开发了一种创新的神经细胞培养模型,揭示了神经变性背后的复杂机制。他们的研究确定了一种错误的蛋白质,作为治疗肌萎缩侧索硬化症(ALS)和额颞叶痴呆(FTD)的有希望的治疗靶点。
神经退行性疾病导致我们大脑中的一些神经元死亡,根据受影响的大脑区域导致不同的症状。在肌萎缩性侧索硬化症(ALS)中,运动皮层和脊髓中的神经元退化,导致瘫痪。另一方面,在额颞叶痴呆(FTD)中,位于大脑中与认知、语言和人格有关的部分的神经元受到影响。

图1 人类神经网络模型揭示ALS和FTLD中的NPTX2病理
ALS和FTD都是不断发展的疾病,仍然缺乏有效的治疗方法。随着人口老龄化,与年龄相关的神经退行性疾病,如ALS和FTD的患病率预计将增加。
尽管在中枢神经系统神经元中发现了一种名为TDP-43的蛋白质的异常积累,这是绝大多数ALS和约一半的FTD患者的共同因素,但驱动神经退行性变的潜在细胞机制在很大程度上仍然未知。
灵活,耐用,可重复性:ALS和FTD研究的理想细胞培养模型
在他们的研究中,苏黎世大学定量生物医学院的第一作者Marian Hruska-Plochan和通讯作者Magdalini Polymenidou开发了一种新的神经细胞培养模型,该模型复制了神经元中TDP-43的异常行为。利用这个模型,他们发现NPTX2蛋白的毒性增加,表明它是ALS和FTD的潜在治疗靶点。
为了模拟神经退化,Marian Hruska-Plochan开发了一种新的细胞培养模型,称为“iNets”,来源于人类诱导多能干细胞。这些细胞起源于皮肤细胞,并在实验室中被重新编程到非常早期的未分化阶段,作为发展许多不同的,期望的细胞类型的来源。神经网络是由相互连接的神经元和它们的支持细胞组成的网络,这些细胞在培养皿中生长成多层。

图2 iCoMoNSC神经元形成功能网络
这种培养持续的时间特别长——长达一年——而且很容易繁殖。“老化的神经网络的健壮性使我们能够进行原本不可能进行的实验,”Hruska-Plochan说。“该模型的灵活性使其适用于各种实验方法。”作为一个恰当的例子,iNets细胞培养为研究TDP-43功能障碍到神经退行性变的进展提供了理想的模型。
蛋白质功能障碍如何导致神经退行性变
利用inet模型,研究人员发现了NPTX2的毒性积累,这是一种通常由神经元通过突触分泌的蛋白质,是TDP-43行为不当和神经元死亡之间缺失的一环。为了验证他们的假设,他们检查了已故ALS和FTD患者的脑组织,确实发现,同样在患者中,NPTX2积聚在含有异常TDP-43的细胞中。这意味着iNets培养模型准确地预测了ALS和FTD患者的病理。
在inet模型的其他实验中,研究人员测试了NPTX2是否可以成为治疗ALS和FTD的药物设计的靶点。该团队设计了一个设置,当神经元遭受TDP-43行为不当时,他们降低了NPTX2的水平。他们发现,保持低水平的NPTX2可以抵消iNets神经元的神经变性。因此,减少NPTX2蛋白含量的药物有可能成为阻止ALS和FTD患者神经退行性变的治疗策略。
Magdalini Polymenidou看到了这一发现的巨大希望:“在将其应用于患者之前,我们还有很长的路要走,但NPTX2的发现给了我们一个明确的目标,即开发一种针对疾病核心的治疗方法,”她说。她补充说:“结合其他研究小组最近确定的另外两个靶点,可以想象,抗nptx2药物可能在未来成为ALS和FTD联合治疗的关键组成部分。”
参考资料
[1] A model of human neural networks reveals NPTX2 pathology in ALS and FTLD



