摘要:一项研究发现,抗精神病药物阿塞那平(asenapine)可能通过TAAR1受体起作用,从而揭示了人类和啮齿动物TAAR1之间的关键差异。
西奈山伊坎大学的科学家们用CryoEM拍摄了药物如何与TAAR1受体结合的详细照片。他们还发现,抗精神病药物阿塞那平出人意料地激活了TAAR1,这可能有助于阿塞那平的治疗效果。研究揭示了TAAR1,指出了药物开发中潜在的增强机会。
西奈山伊坎医学院的研究人员发现了抗精神病药物阿塞那平的潜在作用机制,阿塞那平可能是药物使用和神经精神疾病的治疗靶点。这一发现可能为开发针对相同途径的改进药物铺平道路。
他们的研究结果详细发表在1月2日的《自然通讯》(Nature Communications)网络版上。研究表明,一种被称为TAAR1受体的脑蛋白(一种已知调节大脑关键奖赏通路中多巴胺信号的药物靶点)与临床前啮齿类动物模型(通常用于药物测试)相比,在人类身上存在显著差异。

图1 人类微量胺相关受体1激活的分子基础
该研究建议考虑药物受体相互作用的物种特异性差异,并进一步研究阿塞那平影响身体的方式,作为潜在治疗改进的步骤。
“在研究TAAR1的功能和结构特性时,我们的研究旨在更多地阐明其机制和药理学,”该研究的第一作者、伊坎西奈山的博士候选人 Gregory Zilberg说。“我们的发现可能会指导新型TAAR1药物的开发,并促使更多类似阿塞那平的药物的探索。”
利用先进的技术研究TAAR1的结构和功能,研究人员确定了三个重要的元素。首先,啮齿动物和人类TAAR1之间存在差异,这可能会影响临床前模型研究如何转化为人类。其次,TAAR1与血清素和多巴胺受体的关系比之前认为的要密切得多。这表明,几种以血清素为靶点的药物可能具有未知的治疗效果或副作用,实际上是由于它们在TAAR1上的作用。
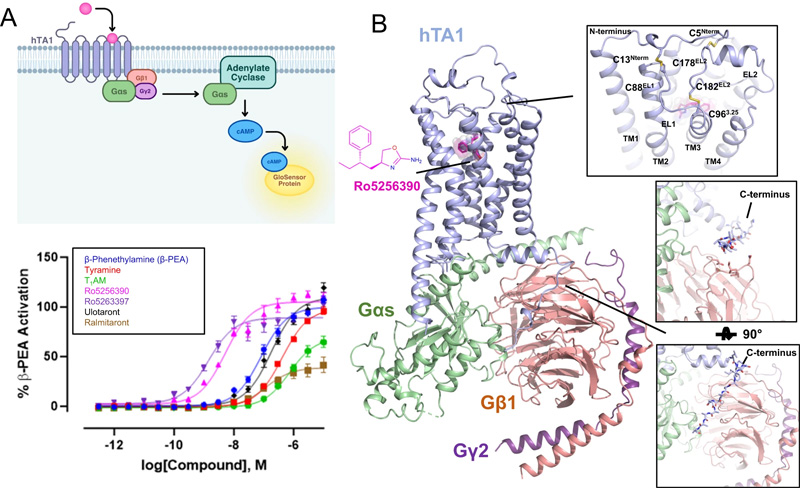
图2 hTA1-Gs复合物的药理学和结构特征
最后,研究人员强调,临床使用的抗精神病药物阿塞那平意外地显示出TAAR1的强烈激活,这表明事实上,这种靶向5 -羟色胺和多巴胺的抗精神病药物可能从TAAR1的激活中获得一些治疗效果。如果在进一步的研究中得到证实,这可能为其在其他与taar1相关的治疗应用中的潜力开辟新的可能性,例如在物质使用障碍中的使用,以及开发新的基于阿塞那平的药物。
研究人员指出,缺乏关于TAAR1在啮齿动物和人类中如何起作用的差异的信息,并强调这些差异中的一些可以解释为什么TAAR1的临床前数据尚未成功转化为有效的人类治疗方法。接下来,研究人员计划研究TAAR1在细胞中的位置,以及它在影响血清素和多巴胺信号传导中的确切作用。
“这项研究为理解TAAR1提供了重大飞跃,为药物开发提供了潜在途径,并鼓励进一步研究其治疗应用,”伊坎西奈山药理学和神经科学助理教授Daniel Wacker博士说。“随着我们工作的进展,我们预计它可能在形成针对TAAR1的新药开发中发挥关键作用,并为类似阿塞那平的药物如何起作用提供有价值的见解。”
参考资料
[1] “Molecular basis of human trace amine-associated receptor 1 activation” by Gregory Zilberg, Alexandra K. Parpounas, Audrey L. Warren, Shifan Yang and Daniel Wacker, 2 January 2024, Nature Communications.
摘要:一项研究发现,抗精神病药物阿塞那平(asenapine)可能通过TAAR1受体起作用,从而揭示了人类和啮齿动物TAAR1之间的关键差异。
西奈山伊坎大学的科学家们用CryoEM拍摄了药物如何与TAAR1受体结合的详细照片。他们还发现,抗精神病药物阿塞那平出人意料地激活了TAAR1,这可能有助于阿塞那平的治疗效果。研究揭示了TAAR1,指出了药物开发中潜在的增强机会。
西奈山伊坎医学院的研究人员发现了抗精神病药物阿塞那平的潜在作用机制,阿塞那平可能是药物使用和神经精神疾病的治疗靶点。这一发现可能为开发针对相同途径的改进药物铺平道路。
他们的研究结果详细发表在1月2日的《自然通讯》(Nature Communications)网络版上。研究表明,一种被称为TAAR1受体的脑蛋白(一种已知调节大脑关键奖赏通路中多巴胺信号的药物靶点)与临床前啮齿类动物模型(通常用于药物测试)相比,在人类身上存在显著差异。

图1 人类微量胺相关受体1激活的分子基础
该研究建议考虑药物受体相互作用的物种特异性差异,并进一步研究阿塞那平影响身体的方式,作为潜在治疗改进的步骤。
“在研究TAAR1的功能和结构特性时,我们的研究旨在更多地阐明其机制和药理学,”该研究的第一作者、伊坎西奈山的博士候选人 Gregory Zilberg说。“我们的发现可能会指导新型TAAR1药物的开发,并促使更多类似阿塞那平的药物的探索。”
利用先进的技术研究TAAR1的结构和功能,研究人员确定了三个重要的元素。首先,啮齿动物和人类TAAR1之间存在差异,这可能会影响临床前模型研究如何转化为人类。其次,TAAR1与血清素和多巴胺受体的关系比之前认为的要密切得多。这表明,几种以血清素为靶点的药物可能具有未知的治疗效果或副作用,实际上是由于它们在TAAR1上的作用。

图2 hTA1-Gs复合物的药理学和结构特征
最后,研究人员强调,临床使用的抗精神病药物阿塞那平意外地显示出TAAR1的强烈激活,这表明事实上,这种靶向5 -羟色胺和多巴胺的抗精神病药物可能从TAAR1的激活中获得一些治疗效果。如果在进一步的研究中得到证实,这可能为其在其他与taar1相关的治疗应用中的潜力开辟新的可能性,例如在物质使用障碍中的使用,以及开发新的基于阿塞那平的药物。
研究人员指出,缺乏关于TAAR1在啮齿动物和人类中如何起作用的差异的信息,并强调这些差异中的一些可以解释为什么TAAR1的临床前数据尚未成功转化为有效的人类治疗方法。接下来,研究人员计划研究TAAR1在细胞中的位置,以及它在影响血清素和多巴胺信号传导中的确切作用。
“这项研究为理解TAAR1提供了重大飞跃,为药物开发提供了潜在途径,并鼓励进一步研究其治疗应用,”伊坎西奈山药理学和神经科学助理教授Daniel Wacker博士说。“随着我们工作的进展,我们预计它可能在形成针对TAAR1的新药开发中发挥关键作用,并为类似阿塞那平的药物如何起作用提供有价值的见解。”
参考资料
[1] “Molecular basis of human trace amine-associated receptor 1 activation” by Gregory Zilberg, Alexandra K. Parpounas, Audrey L. Warren, Shifan Yang and Daniel Wacker, 2 January 2024, Nature Communications.



