摘要:最近,德国弗莱堡大学医学院的一个研究团队开发出一种活性物质,未来有望成为新的治疗选择。
在德国,每年有65,000多名男性罹患前列腺癌。其中,大约12,000人发展为耐药性癌症,最终导致死亡。前列腺癌一般发展缓慢,直到疾病晚期才出现症状。
最近,德国弗莱堡大学医学院的一个研究团队开发出一种活性物质,未来有望成为新的治疗选择。这种被称为KMI169的化合物靶向一种在前列腺癌发展过程中起重要作用的酶。
这项研究成果于2024年1月2日发表在《Nature Communications》杂志上,对于在常规治疗中出现耐药性的其他癌症也同样表现出巨大的潜力。
 图1 具有细胞活性的甲基转移酶选择性抑制剂KMT9的结构导向设计
图1 具有细胞活性的甲基转移酶选择性抑制剂KMT9的结构导向设计通过小分子来抑制表观遗传调控因子是一种极具吸引力的癌症治疗策略。研究人员之前分析了赖氨酸甲基转移酶9(KMT9)在前列腺癌、肺癌和结肠癌中的作用。他们观察到,肿瘤细胞的增殖需要这种酶的活性,因此KMT9是一种潜在的治疗靶点。
于是,他们通过基于结构的药物设计开发出一种强效的选择性抑制剂KMI169。KMI169是一种双底物抑制剂,以辅因子S-腺苷-L-甲硫氨酸(SAM)和KMT9的底物结合口袋为靶点,具有高效力和高选择性。
抑制KMT9可以选择性地下调参与细胞周期调控的目标基因,并抑制肿瘤细胞的增殖,包括对去势和恩杂鲁胺(enzalutamide)产生耐药性的前列腺癌细胞。
通讯作者、弗莱堡大学的Roland Schüle教授和Eric Metzger博士称:“长期以来,我们一直关注KMT9酶,将其作为前列腺癌的潜在靶点。如今这种特异性抑制剂的开发是朝着更有效地抗击前列腺癌迈出了决定性的一步。”
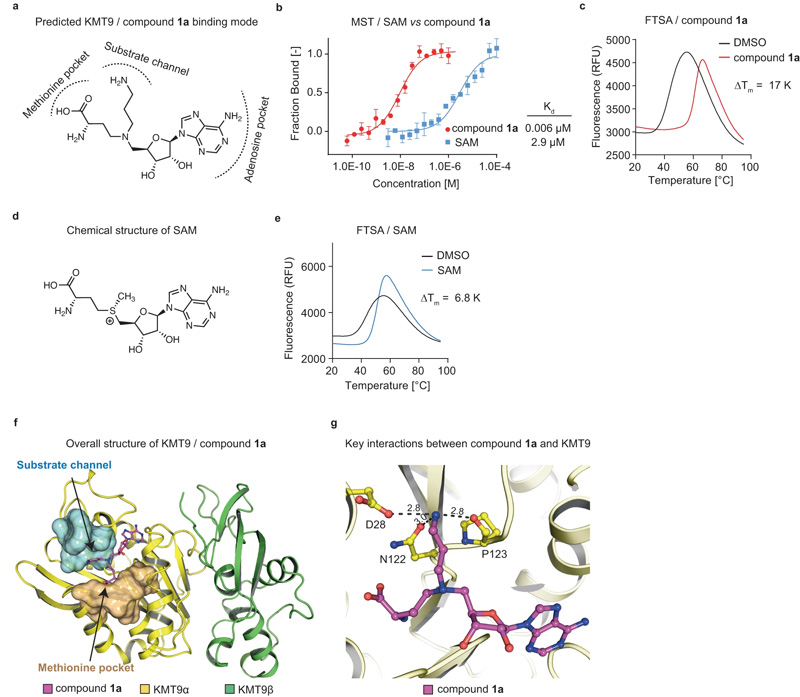
图2 KMT9双底物抑制剂的鉴定
这种化合物可用于耐药性癌症的治疗,因此特别有价值。“治疗耐药性意味着经典的抗激素疗法往往在几个月内就会失效,然后疾病迅速发展。我们开发的抑制剂提供了一种高度创新的治疗方法,” Schüle教授说。
他们的合作者、弗莱堡大学的Manfred Jung教授表示:“这种抑制剂就像锁和钥匙一样紧密配合,阻断了KMT9的功能,因此也阻断了前列腺癌和膀胱癌细胞的生长。在晶体结构分析的指导下,我们对这种化合物进行了多次改良,以提高其效力、选择性和药用性能。”
KMI169抑制剂不仅是探究KMT9功能的重要工具,也为开发临床候选抑制剂来治疗恶性肿瘤铺平了道路。
参考资料
[1] Structure-guided design of a selective inhibitor of the methyltransferase KMT9 with cellular activity
摘要:最近,德国弗莱堡大学医学院的一个研究团队开发出一种活性物质,未来有望成为新的治疗选择。
在德国,每年有65,000多名男性罹患前列腺癌。其中,大约12,000人发展为耐药性癌症,最终导致死亡。前列腺癌一般发展缓慢,直到疾病晚期才出现症状。
最近,德国弗莱堡大学医学院的一个研究团队开发出一种活性物质,未来有望成为新的治疗选择。这种被称为KMI169的化合物靶向一种在前列腺癌发展过程中起重要作用的酶。
这项研究成果于2024年1月2日发表在《Nature Communications》杂志上,对于在常规治疗中出现耐药性的其他癌症也同样表现出巨大的潜力。
 图1 具有细胞活性的甲基转移酶选择性抑制剂KMT9的结构导向设计
图1 具有细胞活性的甲基转移酶选择性抑制剂KMT9的结构导向设计通过小分子来抑制表观遗传调控因子是一种极具吸引力的癌症治疗策略。研究人员之前分析了赖氨酸甲基转移酶9(KMT9)在前列腺癌、肺癌和结肠癌中的作用。他们观察到,肿瘤细胞的增殖需要这种酶的活性,因此KMT9是一种潜在的治疗靶点。
于是,他们通过基于结构的药物设计开发出一种强效的选择性抑制剂KMI169。KMI169是一种双底物抑制剂,以辅因子S-腺苷-L-甲硫氨酸(SAM)和KMT9的底物结合口袋为靶点,具有高效力和高选择性。
抑制KMT9可以选择性地下调参与细胞周期调控的目标基因,并抑制肿瘤细胞的增殖,包括对去势和恩杂鲁胺(enzalutamide)产生耐药性的前列腺癌细胞。
通讯作者、弗莱堡大学的Roland Schüle教授和Eric Metzger博士称:“长期以来,我们一直关注KMT9酶,将其作为前列腺癌的潜在靶点。如今这种特异性抑制剂的开发是朝着更有效地抗击前列腺癌迈出了决定性的一步。”

图2 KMT9双底物抑制剂的鉴定
这种化合物可用于耐药性癌症的治疗,因此特别有价值。“治疗耐药性意味着经典的抗激素疗法往往在几个月内就会失效,然后疾病迅速发展。我们开发的抑制剂提供了一种高度创新的治疗方法,” Schüle教授说。
他们的合作者、弗莱堡大学的Manfred Jung教授表示:“这种抑制剂就像锁和钥匙一样紧密配合,阻断了KMT9的功能,因此也阻断了前列腺癌和膀胱癌细胞的生长。在晶体结构分析的指导下,我们对这种化合物进行了多次改良,以提高其效力、选择性和药用性能。”
KMI169抑制剂不仅是探究KMT9功能的重要工具,也为开发临床候选抑制剂来治疗恶性肿瘤铺平了道路。
参考资料
[1] Structure-guided design of a selective inhibitor of the methyltransferase KMT9 with cellular activity



