摘要:MRC分子生物学实验室的科学家们已经确定TAF15蛋白聚集体是额颞叶痴呆的一个关键因素
大多数神经退行性疾病,包括痴呆症,都涉及蛋白质聚集成一种叫做淀粉样蛋白的细丝。在大多数这些疾病中,研究人员已经确定了聚集的蛋白质,使他们能够针对这些蛋白质进行诊断测试和治疗。
但是,在大约10%的额颞叶痴呆病例中,科学家们尚未识别出这种流氓蛋白质。现在,科学家们已经确定了这些病例中TAF15蛋白的聚集结构。
额颞叶痴呆的本质
额颞叶痴呆是由大脑额叶和颞叶的退化引起的,而大脑额叶和颞叶控制着情绪、个性和行为,以及言语和对文字的理解。它的发病年龄往往比阿尔茨海默病年轻,通常在45至65岁的人群中被诊断出来,尽管它也可能影响年轻人或老年人。
发表在《Nature》杂志上的一篇论文中,由英国剑桥医学研究委员会(MRC)分子生物学实验室的科学家领导的研究发现了一种蛋白质的聚集结构,这种蛋白质可以为未来诊断测试和治疗的发展提供一个目标。

图1 额颞叶退化的TAF15淀粉样丝状蛋白
分子认识的突破
在MRC分子生物学实验室领导这项研究的Benjamin Ryskeldi-Falcon博士说:“这一发现改变了我们对额颞叶痴呆分子基础的理解。这是一项罕见的发现,发现了已知在神经退行性疾病中聚集的一小群蛋白质的新成员。现在我们已经确定了关键蛋白质及其结构,我们可以开始针对这种类型的额颞叶痴呆进行诊断和治疗,类似于已经在开发的针对淀粉样蛋白- β和tau蛋白聚集的策略,这些蛋白是阿尔茨海默病的特征。”
先进的技术揭示新的见解
科学家们使用尖端的冷冻电子显微镜(cryo-EM)以原子分辨率研究了四名患有这种额颞叶痴呆的人的大脑中的蛋白质聚集体。捐献的大脑由伦敦大学学院皇后广场神经病学研究所的Tammaryn Lashley和印第安纳大学医学院的Bernardino Ghetti鉴定。
长期以来,基于与其他神经退行性疾病的相似性,科学家们一直认为,在这种类型的痴呆症中,一种名为FUS的蛋白质聚集在一起。
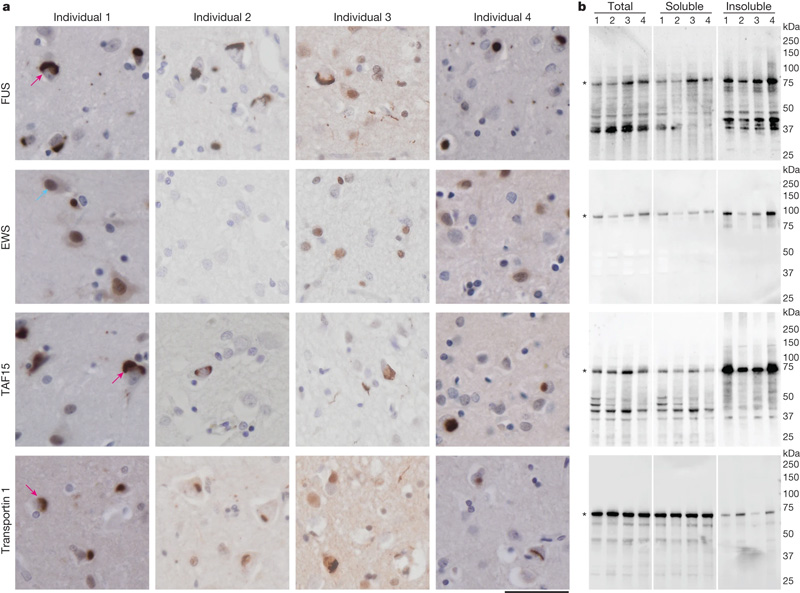
图2 额颞叶退化蛋白包含FET蛋白和远转蛋白1
通过冷冻电镜,MRC分子生物学实验室的研究人员能够确定来自每个大脑的蛋白质聚集体具有相同的原子结构。令人惊讶的是,这种蛋白质不是FUS,而是另一种叫做TAF15的蛋白质。
同样来自MRC分子生物学实验室的Stephan Tetter博士是该论文的第一作者,他说:“这是一个意想不到的结果,因为在这项研究之前,人们并不知道TAF15会在神经退行性疾病中形成淀粉样蛋白细丝,也不存在这种蛋白质的结构。Cryo-EM正在更广泛地改变我们对痴呆症和神经退行性疾病分子病理学的理解,为我们提供了超越以往技术能力的见解。”
Ryskeldi-Falcon博士补充说:“执行冷冻电镜技术的挑战意味着我们只能看到四个人的大脑。然而,现在我们知道了关键蛋白质及其结构,我们有潜力开发工具来筛选数百个患者样本中的这些异常蛋白质聚集体,以测试它们的普遍程度。”
额颞叶痴呆和运动神经元疾病
一些患有额颞叶痴呆的人还患有运动神经元疾病,这是一种个体逐渐失去对肌肉控制的疾病。在这项研究中,捐献大脑的两个人同时患有这两种疾病。对于这些个体,研究人员在与运动神经元疾病相关的大脑区域发现了相同的TAF15聚集结构。
Ryskeldi-Falcon博士说:“在两个患有额颞叶痴呆和运动神经元疾病的个体中存在相同的TAF15聚集物,这增加了TAF15可能导致这两种疾病的可能性。我们现在正在研究在没有额颞叶痴呆的运动神经元疾病患者中是否存在异常聚集的TAF15。”
医学研究委员会分子和细胞医学委员会主席Charlotte Durkin博士说:“MRC分子生物学实验室数十年的世界领先研究带来了低温电子显微镜的突破-为Richard Henderson博士赢得了2017年的诺贝尔奖。这项最新研究鉴定了与一种额颞叶痴呆相关的蛋白质,延续了MRC LMB通过低温电镜成功阐明痴呆相关蛋白质结构的成果,其中包括关键痴呆蛋白tau的第一个结构。了解这种罕见的早发性痴呆症中这些纤维的特征和基本结构,对于开发早期诊断测试和药物来对抗它们的形成至关重要。”
参考资料
[1] Stephan Tetter, Diana Arseni, Alexey G. Murzin, Yazead Buhidma, Sew Y. Peak-Chew, Holly J. Garringer, Kathy L. Newell, Ruben Vidal, Liana G. Apostolova, Tammaryn Lashley, Bernardino Ghetti and Benjamin Ryskeldi-Falcon,TAF15 amyloid filaments in frontotemporal lobar degeneration, 6 December 2023, Nature
摘要:MRC分子生物学实验室的科学家们已经确定TAF15蛋白聚集体是额颞叶痴呆的一个关键因素
大多数神经退行性疾病,包括痴呆症,都涉及蛋白质聚集成一种叫做淀粉样蛋白的细丝。在大多数这些疾病中,研究人员已经确定了聚集的蛋白质,使他们能够针对这些蛋白质进行诊断测试和治疗。
但是,在大约10%的额颞叶痴呆病例中,科学家们尚未识别出这种流氓蛋白质。现在,科学家们已经确定了这些病例中TAF15蛋白的聚集结构。
额颞叶痴呆的本质
额颞叶痴呆是由大脑额叶和颞叶的退化引起的,而大脑额叶和颞叶控制着情绪、个性和行为,以及言语和对文字的理解。它的发病年龄往往比阿尔茨海默病年轻,通常在45至65岁的人群中被诊断出来,尽管它也可能影响年轻人或老年人。
发表在《Nature》杂志上的一篇论文中,由英国剑桥医学研究委员会(MRC)分子生物学实验室的科学家领导的研究发现了一种蛋白质的聚集结构,这种蛋白质可以为未来诊断测试和治疗的发展提供一个目标。

图1 额颞叶退化的TAF15淀粉样丝状蛋白
分子认识的突破
在MRC分子生物学实验室领导这项研究的Benjamin Ryskeldi-Falcon博士说:“这一发现改变了我们对额颞叶痴呆分子基础的理解。这是一项罕见的发现,发现了已知在神经退行性疾病中聚集的一小群蛋白质的新成员。现在我们已经确定了关键蛋白质及其结构,我们可以开始针对这种类型的额颞叶痴呆进行诊断和治疗,类似于已经在开发的针对淀粉样蛋白- β和tau蛋白聚集的策略,这些蛋白是阿尔茨海默病的特征。”
先进的技术揭示新的见解
科学家们使用尖端的冷冻电子显微镜(cryo-EM)以原子分辨率研究了四名患有这种额颞叶痴呆的人的大脑中的蛋白质聚集体。捐献的大脑由伦敦大学学院皇后广场神经病学研究所的Tammaryn Lashley和印第安纳大学医学院的Bernardino Ghetti鉴定。
长期以来,基于与其他神经退行性疾病的相似性,科学家们一直认为,在这种类型的痴呆症中,一种名为FUS的蛋白质聚集在一起。

图2 额颞叶退化蛋白包含FET蛋白和远转蛋白1
通过冷冻电镜,MRC分子生物学实验室的研究人员能够确定来自每个大脑的蛋白质聚集体具有相同的原子结构。令人惊讶的是,这种蛋白质不是FUS,而是另一种叫做TAF15的蛋白质。
同样来自MRC分子生物学实验室的Stephan Tetter博士是该论文的第一作者,他说:“这是一个意想不到的结果,因为在这项研究之前,人们并不知道TAF15会在神经退行性疾病中形成淀粉样蛋白细丝,也不存在这种蛋白质的结构。Cryo-EM正在更广泛地改变我们对痴呆症和神经退行性疾病分子病理学的理解,为我们提供了超越以往技术能力的见解。”
Ryskeldi-Falcon博士补充说:“执行冷冻电镜技术的挑战意味着我们只能看到四个人的大脑。然而,现在我们知道了关键蛋白质及其结构,我们有潜力开发工具来筛选数百个患者样本中的这些异常蛋白质聚集体,以测试它们的普遍程度。”
额颞叶痴呆和运动神经元疾病
一些患有额颞叶痴呆的人还患有运动神经元疾病,这是一种个体逐渐失去对肌肉控制的疾病。在这项研究中,捐献大脑的两个人同时患有这两种疾病。对于这些个体,研究人员在与运动神经元疾病相关的大脑区域发现了相同的TAF15聚集结构。
Ryskeldi-Falcon博士说:“在两个患有额颞叶痴呆和运动神经元疾病的个体中存在相同的TAF15聚集物,这增加了TAF15可能导致这两种疾病的可能性。我们现在正在研究在没有额颞叶痴呆的运动神经元疾病患者中是否存在异常聚集的TAF15。”
医学研究委员会分子和细胞医学委员会主席Charlotte Durkin博士说:“MRC分子生物学实验室数十年的世界领先研究带来了低温电子显微镜的突破-为Richard Henderson博士赢得了2017年的诺贝尔奖。这项最新研究鉴定了与一种额颞叶痴呆相关的蛋白质,延续了MRC LMB通过低温电镜成功阐明痴呆相关蛋白质结构的成果,其中包括关键痴呆蛋白tau的第一个结构。了解这种罕见的早发性痴呆症中这些纤维的特征和基本结构,对于开发早期诊断测试和药物来对抗它们的形成至关重要。”
参考资料
[1] Stephan Tetter, Diana Arseni, Alexey G. Murzin, Yazead Buhidma, Sew Y. Peak-Chew, Holly J. Garringer, Kathy L. Newell, Ruben Vidal, Liana G. Apostolova, Tammaryn Lashley, Bernardino Ghetti and Benjamin Ryskeldi-Falcon,TAF15 amyloid filaments in frontotemporal lobar degeneration, 6 December 2023, Nature



