摘要:抗生素clovibactin能够有效地杀死耐药的革兰氏阳性细菌病原体,而不会产生可检测到的耐药性。
抗生素的引入彻底改变了医学,为曾经致命的传染病提供了有效的治疗方法,并使外科手术和器官移植等现代医学成为可能。广泛的耐药性发展阻碍了抗生素的有效性和使用寿命,要求在与人类病原体的永久对峙中发现新的药物。
2023年8月22日,荷兰乌得勒支大学Markus Weingarth、德国波恩大学Tanja Schneider共同通讯在Cell 在线发表题为“An antibiotic from an uncultured bacterium binds to an immutable target”的研究论文,该研究发现了一种从未培养的土壤细菌中分离出来的抗生素clovibactin,它能够有效地杀死耐药的革兰氏阳性细菌病原体,而不会产生可检测到的耐药性。

图1 研究发现了一种从未培养的土壤细菌中分离出来的抗生素clovibactin
Clovibactin通过靶向多种必需肽聚糖前体(C55PP,脂质II和脂质IIIWTA)的焦磷酸盐来阻断细胞壁的合成。Clovibactin使用一种不寻常的疏水界面紧密包裹焦磷酸盐,但绕过前体的可变结构元素,导致缺乏抵抗力。选择性和有效的靶标结合是通过将前体隔离到仅在含有脂锚定焦磷酸基团的细菌膜上形成的超分子原纤维中来实现的。这种有效的抗生素有希望设计出更好的治疗方法,在不产生耐药性的情况下杀死细菌病原体。
临床上使用的大多数抗生素来源于天然产物骨架,这些骨架是通过筛选土壤栖息细菌而发现的。这种由“Waksman 平台”引领的方法在20世纪40年代至60年代取得了巨大成功,被认为是抗生素发现的黄金时代,并最终导致了链霉素、万古霉素或四环素等化合物的引入。然而,到目前为止,传统的筛选来源似乎被破坏了,因为它们往往产生以前已知的化合物。由于药物发现渠道已经相当薄弱,因此在尚未开发的细菌生产者群体中寻找具有前所未有的作用机制的新抗生素是谨慎的。
在过去的几十年里,传统的筛选平台未能引入新的抗生素,部分原因是放线菌的过度开采,放线菌是抗生素的传统来源。通过获取沉默的操纵子,发现被大量产生的抗菌素掩盖的化合物,以及培养以前未培养的细菌,可能会发现新的抗生素。
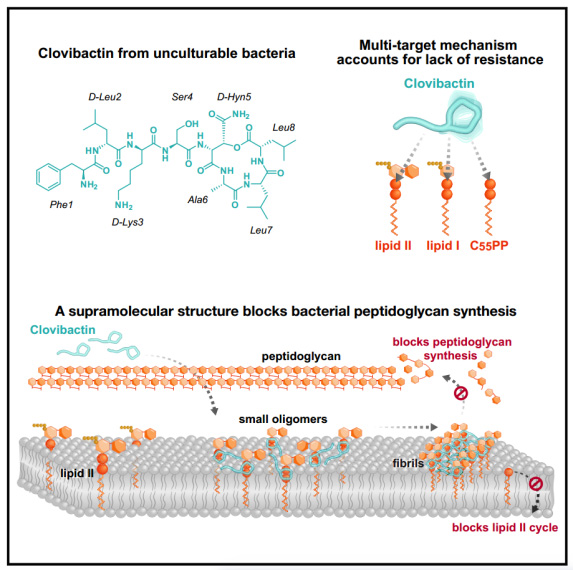
图2 机理模式图(图源自Cell)
未培养的细菌代表了巨大的、未开发的新天然产物骨架来源。最近,iChip技术的发展提供了广泛多样性的未培养细菌物种,导致Teixobactin的发现,其从土壤细菌Eleftheria terrae中分离出来。Teixobactin具有优异的抗菌活性和独特的化学结构。Teixobactin通过特异性结合高度保守的脂质前体来阻断细胞壁的生物合成,导致超分子结构的形成,从而扰乱膜的稳定性。筛选未培养细菌后产生的其他具有新作用模式的抗生素是lassomycin (ClpP1P2C1蛋白酶抑制剂)和amycoactin (SecY蛋白输出抑制剂),两者都选择性地作用于分枝杆菌。因此,未经培养的细菌似乎提供了丰富的化合物来源,具有新的化学和机械特性,这预示着持续发现有效的线索来开发下一代抗生素。
该研究报告了clovibactin的发现和作用模式,是一种未检测到耐药性的抗生素,从未培养的细菌中鉴定出来。它是一种新的作用于细胞壁的抗生素, clovibactin对细胞壁前体PPi的作用是一个简单的不可变靶点,它扩展了人们对为避免耐药性而进化的抗生素的理解,并为合理设计具有长期临床使用寿命的化合物指明了道路。。
参考资料
[1] An antibiotic from an uncultured bacterium binds to an immutable target
摘要:抗生素clovibactin能够有效地杀死耐药的革兰氏阳性细菌病原体,而不会产生可检测到的耐药性。
抗生素的引入彻底改变了医学,为曾经致命的传染病提供了有效的治疗方法,并使外科手术和器官移植等现代医学成为可能。广泛的耐药性发展阻碍了抗生素的有效性和使用寿命,要求在与人类病原体的永久对峙中发现新的药物。
2023年8月22日,荷兰乌得勒支大学Markus Weingarth、德国波恩大学Tanja Schneider共同通讯在Cell 在线发表题为“An antibiotic from an uncultured bacterium binds to an immutable target”的研究论文,该研究发现了一种从未培养的土壤细菌中分离出来的抗生素clovibactin,它能够有效地杀死耐药的革兰氏阳性细菌病原体,而不会产生可检测到的耐药性。

图1 研究发现了一种从未培养的土壤细菌中分离出来的抗生素clovibactin
Clovibactin通过靶向多种必需肽聚糖前体(C55PP,脂质II和脂质IIIWTA)的焦磷酸盐来阻断细胞壁的合成。Clovibactin使用一种不寻常的疏水界面紧密包裹焦磷酸盐,但绕过前体的可变结构元素,导致缺乏抵抗力。选择性和有效的靶标结合是通过将前体隔离到仅在含有脂锚定焦磷酸基团的细菌膜上形成的超分子原纤维中来实现的。这种有效的抗生素有希望设计出更好的治疗方法,在不产生耐药性的情况下杀死细菌病原体。
临床上使用的大多数抗生素来源于天然产物骨架,这些骨架是通过筛选土壤栖息细菌而发现的。这种由“Waksman 平台”引领的方法在20世纪40年代至60年代取得了巨大成功,被认为是抗生素发现的黄金时代,并最终导致了链霉素、万古霉素或四环素等化合物的引入。然而,到目前为止,传统的筛选来源似乎被破坏了,因为它们往往产生以前已知的化合物。由于药物发现渠道已经相当薄弱,因此在尚未开发的细菌生产者群体中寻找具有前所未有的作用机制的新抗生素是谨慎的。
在过去的几十年里,传统的筛选平台未能引入新的抗生素,部分原因是放线菌的过度开采,放线菌是抗生素的传统来源。通过获取沉默的操纵子,发现被大量产生的抗菌素掩盖的化合物,以及培养以前未培养的细菌,可能会发现新的抗生素。

图2 机理模式图(图源自Cell)
未培养的细菌代表了巨大的、未开发的新天然产物骨架来源。最近,iChip技术的发展提供了广泛多样性的未培养细菌物种,导致Teixobactin的发现,其从土壤细菌Eleftheria terrae中分离出来。Teixobactin具有优异的抗菌活性和独特的化学结构。Teixobactin通过特异性结合高度保守的脂质前体来阻断细胞壁的生物合成,导致超分子结构的形成,从而扰乱膜的稳定性。筛选未培养细菌后产生的其他具有新作用模式的抗生素是lassomycin (ClpP1P2C1蛋白酶抑制剂)和amycoactin (SecY蛋白输出抑制剂),两者都选择性地作用于分枝杆菌。因此,未经培养的细菌似乎提供了丰富的化合物来源,具有新的化学和机械特性,这预示着持续发现有效的线索来开发下一代抗生素。
该研究报告了clovibactin的发现和作用模式,是一种未检测到耐药性的抗生素,从未培养的细菌中鉴定出来。它是一种新的作用于细胞壁的抗生素, clovibactin对细胞壁前体PPi的作用是一个简单的不可变靶点,它扩展了人们对为避免耐药性而进化的抗生素的理解,并为合理设计具有长期临床使用寿命的化合物指明了道路。。
参考资料
[1] An antibiotic from an uncultured bacterium binds to an immutable target



