摘要:PNP编辑作为一种通用的可编程工具出现,用于特定位点的DNA操作。
一项创新的基因组编辑技术可以增强基因修饰治疗工具的传递、特异性和靶向性。
kaust开发的方法结合了两种分子技术:一种合成的dna样分子家族,称为肽核酸(PNAs),以及一类称为原核Argonautes (pAgos)的dna切割酶。

图1 一项创新的基因组编辑技术用于特定位点的DNA操作
PNAs首先解压缩并滑入DNA螺旋。pAgos在遗传物质短片段的引导下,在特定的目标序列上结合松散的螺旋,并切割每一条相反的DNA链。
通过将这两种成分配对,研究人员实现了一种称为pna辅助pAgo编辑或PNP编辑的新方法,该方法在基因组的精确位置引入了靶向断裂。
在许多方面,这种方法与其他基因编辑平台相似。然而,与CRISPR等更成熟的方法相比,PNP编辑具有明显的优势。
原则上,它应该在基因组中的更多位置起作用,准确地在双链DNA中产生断裂,减少可能造成安全风险的脱靶活动的机会。
此外,部件的小尺寸应该有助于将基因编辑工具包装和运送到目标组织,甚至进入亚细胞区室,如线粒体,细胞的动力工厂和其他细胞器。
领导这项研究的KAUST生物工程师Magdy Mahfouz说:“我们建立的技术显著提高了可用于基因编辑的可编程双链断裂的效率和活性。”
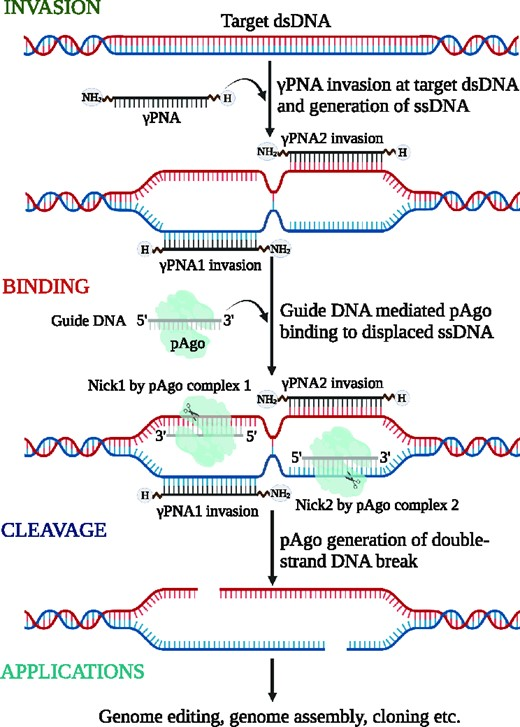
图2 机理模式图
通过详尽的实验,Mahfouz和他的同事评估了修饰PNAs、pAgo蛋白、引导分子、靶序列、实验条件等的不同组合。这些努力最终证明了PNP编辑为跨所有形式的DNA材料的特定位点基因操作提供了一个灵活和可编程的平台。
然而,在PNP编辑可以用于临床应用之前,还需要进一步的改进。Mahfouz实验室的博士生、该研究报告的第一作者Tin Marsic说:“我们需要优化递送,并在细胞培养实验和动物疾病模型中展示强大的体内活性。”
与基于crispr的方法直接评估PNP编辑的性能也很重要。但迄今为止积累的数据确实“表明我们的概念是通用的,”马西奇说。
通过将PNAs的靶向链入侵与pAgos的精确切片活性结合起来,PNP编辑在许多领域都有前景,包括精准医学、农业和基础科学研究。
[1] Programmable site-specific DNA double-strand breaks via PNA-assisted prokaryotic Argonautes
摘要:PNP编辑作为一种通用的可编程工具出现,用于特定位点的DNA操作。
一项创新的基因组编辑技术可以增强基因修饰治疗工具的传递、特异性和靶向性。
kaust开发的方法结合了两种分子技术:一种合成的dna样分子家族,称为肽核酸(PNAs),以及一类称为原核Argonautes (pAgos)的dna切割酶。

图1 一项创新的基因组编辑技术用于特定位点的DNA操作
PNAs首先解压缩并滑入DNA螺旋。pAgos在遗传物质短片段的引导下,在特定的目标序列上结合松散的螺旋,并切割每一条相反的DNA链。
通过将这两种成分配对,研究人员实现了一种称为pna辅助pAgo编辑或PNP编辑的新方法,该方法在基因组的精确位置引入了靶向断裂。
在许多方面,这种方法与其他基因编辑平台相似。然而,与CRISPR等更成熟的方法相比,PNP编辑具有明显的优势。
原则上,它应该在基因组中的更多位置起作用,准确地在双链DNA中产生断裂,减少可能造成安全风险的脱靶活动的机会。
此外,部件的小尺寸应该有助于将基因编辑工具包装和运送到目标组织,甚至进入亚细胞区室,如线粒体,细胞的动力工厂和其他细胞器。
领导这项研究的KAUST生物工程师Magdy Mahfouz说:“我们建立的技术显著提高了可用于基因编辑的可编程双链断裂的效率和活性。”

图2 机理模式图
通过详尽的实验,Mahfouz和他的同事评估了修饰PNAs、pAgo蛋白、引导分子、靶序列、实验条件等的不同组合。这些努力最终证明了PNP编辑为跨所有形式的DNA材料的特定位点基因操作提供了一个灵活和可编程的平台。
然而,在PNP编辑可以用于临床应用之前,还需要进一步的改进。Mahfouz实验室的博士生、该研究报告的第一作者Tin Marsic说:“我们需要优化递送,并在细胞培养实验和动物疾病模型中展示强大的体内活性。”
与基于crispr的方法直接评估PNP编辑的性能也很重要。但迄今为止积累的数据确实“表明我们的概念是通用的,”马西奇说。
通过将PNAs的靶向链入侵与pAgos的精确切片活性结合起来,PNP编辑在许多领域都有前景,包括精准医学、农业和基础科学研究。
[1] Programmable site-specific DNA double-strand breaks via PNA-assisted prokaryotic Argonautes



