摘要:科学家已经开发出一种纳米孔测序方法,通过监测线性化蛋白质流过纳米孔时产生的细微离子电流来检测翻译后修饰。
在牛津大学,科学家们开发了一种纳米孔技术,可以识别单个蛋白质中的三种不同的翻译后修饰(PTMs),甚至可以识别长蛋白质链的深处。科学家们断言,他们的技术“为编制细胞和组织中的蛋白质形态清单奠定了基础。”
这项技术发表在《Nature Nanotechnology》杂志上。该论文指出,单分子的蛋白质形态鉴定需要长多肽链结构的知识,这些知识已被证明是难以捉摸的。虽然有通过固态纳米孔或大尺寸蛋白质纳米孔进行折叠蛋白易位的方法,但这些方法尚未在多肽序列中定位PTMs。检测PTMs的方法只能在短肽内检测。

图1 新型纳米孔测序方法通过监测线性化蛋白质流过纳米孔时产生的细微离子电流来检测翻译后修饰
在他们的论文中,牛津大学的科学家们描述了他们的方法:“我们在一个工程电荷选择纳米孔中使用电渗透,对超过1200个残基的单个多肽进行非酶捕获、展开和易位。未标记的硫氧还蛋白多蛋白通过纳米孔进行运输,从C端或N端进行定向共易位展开。非变性浓度的朝变性试剂加速了分析。
科学家们详细阐述了纳米孔DNA/RNA测序技术。具体来说,科学家们使用定向水流来捕获和展开3D蛋白质成线性链,并让它们通过刚好足够宽的孔,允许单个氨基酸通过。结构变化是通过测量施加在纳米孔上的电流的变化来确定的。不同的分子在电流中造成不同的干扰,从而赋予它们独特的特征。
该团队成功地证明了该方法在检测三种不同的PTM修饰(磷酸化、谷胱甘肽化和糖基化)方面的有效性。其中包括蛋白质序列深处的修饰。重要的是,该方法不需要使用标签、酶或其他试剂。
根据研究小组的说法,这种新的蛋白质表征方法可以很容易地集成到现有的便携式纳米孔测序设备中,使研究人员能够快速建立单个细胞和组织的蛋白质清单。这可以促进即时诊断,实现与癌症和神经退行性疾病等疾病相关的特定蛋白质变异的个性化检测。
“这种简单而强大的方法开辟了许多可能性,”牛津大学有机化学副教授、当前研究的通讯作者Yujia Qing博士说。“最初,它允许检查单个蛋白质,例如与特定疾病有关的蛋白质。从长远来看,这种方法有可能在细胞内创建更多的蛋白质变异清单,从而更深入地了解细胞过程和疾病机制。”
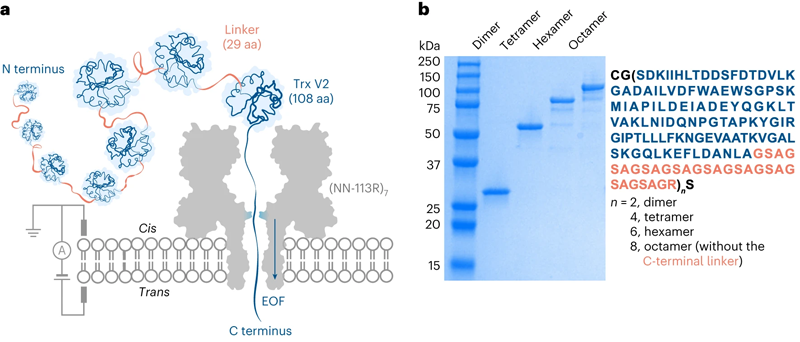
图2 Trx连接子多联体经电渗驱动易位穿过蛋白质纳米孔
当前研究的另一位通讯作者是Hagan Bayley博士,他是牛津大学化学生物学教授,也是牛津纳米孔技术公司的联合创始人。他指出,在单分子水平上精确定位和识别翻译后修饰和其他蛋白质变异的能力“对推进我们对细胞功能和分子相互作用的理解有着巨大的希望。”他补充说,这可能“为个性化医疗、诊断和治疗干预开辟新的途径”。
该研究的作者强调,在单分子水平上分析细胞蛋白质及其数百万变体的技术将揭示生物学以前未知的大量信息。
虽然人类细胞含有大约20,000个蛋白质编码基因,但在细胞中观察到的蛋白质的实际数量要大得多,已知的蛋白质结构超过1,000,000种。这些变异是通过PTMs产生的,PTMs是蛋白质从DNA转录后发生的结构变化。这些变化——比如在组成蛋白质的单个氨基酸上添加化学基团或碳水化合物链——会导致同一蛋白质链产生数百种可能的变化。
这些变异在生物学中发挥着关键作用,通过精确调节单个细胞内复杂的生物过程。PTMs的映射将揭示大量有价值的信息,可能彻底改变我们对细胞功能的理解。
参考资料:
[1] Enzyme-less nanopore detection of post-translational modifications within long polypeptides
摘要:科学家已经开发出一种纳米孔测序方法,通过监测线性化蛋白质流过纳米孔时产生的细微离子电流来检测翻译后修饰。
在牛津大学,科学家们开发了一种纳米孔技术,可以识别单个蛋白质中的三种不同的翻译后修饰(PTMs),甚至可以识别长蛋白质链的深处。科学家们断言,他们的技术“为编制细胞和组织中的蛋白质形态清单奠定了基础。”
这项技术发表在《Nature Nanotechnology》杂志上。该论文指出,单分子的蛋白质形态鉴定需要长多肽链结构的知识,这些知识已被证明是难以捉摸的。虽然有通过固态纳米孔或大尺寸蛋白质纳米孔进行折叠蛋白易位的方法,但这些方法尚未在多肽序列中定位PTMs。检测PTMs的方法只能在短肽内检测。

图1 新型纳米孔测序方法通过监测线性化蛋白质流过纳米孔时产生的细微离子电流来检测翻译后修饰
在他们的论文中,牛津大学的科学家们描述了他们的方法:“我们在一个工程电荷选择纳米孔中使用电渗透,对超过1200个残基的单个多肽进行非酶捕获、展开和易位。未标记的硫氧还蛋白多蛋白通过纳米孔进行运输,从C端或N端进行定向共易位展开。非变性浓度的朝变性试剂加速了分析。
科学家们详细阐述了纳米孔DNA/RNA测序技术。具体来说,科学家们使用定向水流来捕获和展开3D蛋白质成线性链,并让它们通过刚好足够宽的孔,允许单个氨基酸通过。结构变化是通过测量施加在纳米孔上的电流的变化来确定的。不同的分子在电流中造成不同的干扰,从而赋予它们独特的特征。
该团队成功地证明了该方法在检测三种不同的PTM修饰(磷酸化、谷胱甘肽化和糖基化)方面的有效性。其中包括蛋白质序列深处的修饰。重要的是,该方法不需要使用标签、酶或其他试剂。
根据研究小组的说法,这种新的蛋白质表征方法可以很容易地集成到现有的便携式纳米孔测序设备中,使研究人员能够快速建立单个细胞和组织的蛋白质清单。这可以促进即时诊断,实现与癌症和神经退行性疾病等疾病相关的特定蛋白质变异的个性化检测。
“这种简单而强大的方法开辟了许多可能性,”牛津大学有机化学副教授、当前研究的通讯作者Yujia Qing博士说。“最初,它允许检查单个蛋白质,例如与特定疾病有关的蛋白质。从长远来看,这种方法有可能在细胞内创建更多的蛋白质变异清单,从而更深入地了解细胞过程和疾病机制。”

图2 Trx连接子多联体经电渗驱动易位穿过蛋白质纳米孔
当前研究的另一位通讯作者是Hagan Bayley博士,他是牛津大学化学生物学教授,也是牛津纳米孔技术公司的联合创始人。他指出,在单分子水平上精确定位和识别翻译后修饰和其他蛋白质变异的能力“对推进我们对细胞功能和分子相互作用的理解有着巨大的希望。”他补充说,这可能“为个性化医疗、诊断和治疗干预开辟新的途径”。
该研究的作者强调,在单分子水平上分析细胞蛋白质及其数百万变体的技术将揭示生物学以前未知的大量信息。
虽然人类细胞含有大约20,000个蛋白质编码基因,但在细胞中观察到的蛋白质的实际数量要大得多,已知的蛋白质结构超过1,000,000种。这些变异是通过PTMs产生的,PTMs是蛋白质从DNA转录后发生的结构变化。这些变化——比如在组成蛋白质的单个氨基酸上添加化学基团或碳水化合物链——会导致同一蛋白质链产生数百种可能的变化。
这些变异在生物学中发挥着关键作用,通过精确调节单个细胞内复杂的生物过程。PTMs的映射将揭示大量有价值的信息,可能彻底改变我们对细胞功能的理解。
参考资料:
[1] Enzyme-less nanopore detection of post-translational modifications within long polypeptides



