摘要:三方基模蛋白11 (TRIM11) 被发现可以抑制类似阿尔茨海默病(AD)的恶化。
根据宾夕法尼亚大学佩雷尔曼医学院的一项新研究,一种编码与tau蛋白产生相关的蛋白的基因:TRIM11,在类似阿尔茨海默病(AD)的神经退行性疾病的小动物模型中被发现可以抑制恶化,同时提高认知和运动能力。此外,TRIM11被确定在去除导致神经退行性疾病(如AD)的蛋白缠结中起关键作用。研究结果发表在《科学》杂志上。

图1 研究发现一种编码与tau蛋白产生相关的基因TRIM11,在小动物模型中可以抑制类似阿尔茨海默病(AD)的神经退行性疾病恶化
阿尔茨海默病是导致老年人痴呆的最常见原因,这是一种进行性大脑疾病,会慢慢破坏记忆和思维能力。宾夕法尼亚大学医学院的基础研究由Virginia M.Y. Lee博士(阿尔茨海默病病理学和实验室医学研究的John H. Ware III教授)和已故的John Q. Trojanowski博士(老年医学和病理学和实验室医学的老年学教授)领导,揭示了神经退行性疾病的潜在原因之一是tau蛋白的神经原纤维缠结(NFTs),这种缠结会导致神经元死亡,从而引发注意力缺失症的症状,如记忆力丧失。
除AD外,tau蛋白聚集成NFT与20多种其他痴呆和运动障碍有关,包括进行性核上性麻痹、皮克病和慢性创伤性脑病,统称为tau病。然而,在这些疾病的患者中,tau蛋白如何以及为什么聚集在一起并形成构成NFT的纤维聚集体仍不清楚。这一重大知识空白给研究人员开发有效的治疗方法带来了挑战。
宾夕法尼亚大学癌症生物学教授Xiaolu Yang博士说:“大多数生物体都有蛋白质质量控制系统,可以去除有缺陷的蛋白质,防止错误折叠和缠结的积累——就像我们在tau病患者的大脑中看到的tau蛋白一样,但直到现在,我们还不知道这在人类中是如何起作用的,或者为什么它在一些个体中不起作用,而在另一些个体中不起作用。我们第一次确定了监督tau功能的基因,并且有了一个有希望的目标,可以开发治疗方法来预防和减缓阿尔茨海默病和其他相关疾病的进展。”
Yang和他的团队,包括第一作者Zi-Yang Zhang博士,之前发现TRIM蛋白在动物细胞的蛋白质质量控制中起着重要作用。在检查了70多个人类TRIMs后,他们发现TRIM11在抑制tau聚集方面起着重要作用。TRIM11具有与tau蛋白质量控制相关的三个主要功能。首先,它与tau蛋白结合,尤其是导致疾病的突变变体,并帮助消除它们。其次,它充当tau蛋白的“伴侣”,防止蛋白质错误折叠。最后,TRIM11溶解预先存在的tau聚集体。
研究人员利用23名阿尔茨海默病患者的死后脑组织和14名来自神经退行性疾病研究中心组织库的健康对照者进行了验证,发现与健康对照者相比,阿尔茨海默病患者大脑中的TRIM11蛋白水平显著降低。
为了确定TRIM11作为治疗药物的潜在效用,研究人员使用腺相关病毒载体(AAV),一种基因治疗中常用的工具,将TRIM11基因传递到多种小鼠模型的大脑中。研究人员发现,接受TRIM11基因的tau病变小鼠,nft的发育和积累明显减少,认知和运动能力大大提高。
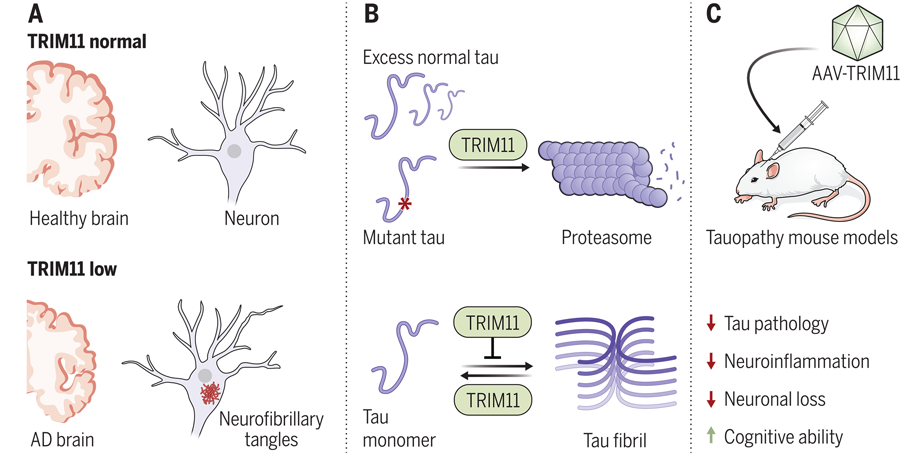
图2 TRIM11在AD脑中的抑制作用及其修复的潜在治疗益处
Yang说:“这些发现不仅告诉我们TRIM11可以在保护人们免受阿尔茨海默氏症和类似疾病方面发挥重要作用,而且我们还看到,我们可能能够开发出未来的治疗方法,在较低水平的个体中补充TRIM11。我们渴望与我们的同事一起探索开发基因疗法的可能性,以阻止神经退行性疾病的进展。”
本研究由美国国立卫生研究院(R01CA243520, UL1TR000003)支持,宾夕法尼亚大学根据与财富战略控股有限公司的赞助研究协议获得资助。
参考资料:
[1] TRIM11 protects against tauopathies and is down-regulated in Alzheimer's disease
摘要:三方基模蛋白11 (TRIM11) 被发现可以抑制类似阿尔茨海默病(AD)的恶化。
根据宾夕法尼亚大学佩雷尔曼医学院的一项新研究,一种编码与tau蛋白产生相关的蛋白的基因:TRIM11,在类似阿尔茨海默病(AD)的神经退行性疾病的小动物模型中被发现可以抑制恶化,同时提高认知和运动能力。此外,TRIM11被确定在去除导致神经退行性疾病(如AD)的蛋白缠结中起关键作用。研究结果发表在《科学》杂志上。

图1 研究发现一种编码与tau蛋白产生相关的基因TRIM11,在小动物模型中可以抑制类似阿尔茨海默病(AD)的神经退行性疾病恶化
阿尔茨海默病是导致老年人痴呆的最常见原因,这是一种进行性大脑疾病,会慢慢破坏记忆和思维能力。宾夕法尼亚大学医学院的基础研究由Virginia M.Y. Lee博士(阿尔茨海默病病理学和实验室医学研究的John H. Ware III教授)和已故的John Q. Trojanowski博士(老年医学和病理学和实验室医学的老年学教授)领导,揭示了神经退行性疾病的潜在原因之一是tau蛋白的神经原纤维缠结(NFTs),这种缠结会导致神经元死亡,从而引发注意力缺失症的症状,如记忆力丧失。
除AD外,tau蛋白聚集成NFT与20多种其他痴呆和运动障碍有关,包括进行性核上性麻痹、皮克病和慢性创伤性脑病,统称为tau病。然而,在这些疾病的患者中,tau蛋白如何以及为什么聚集在一起并形成构成NFT的纤维聚集体仍不清楚。这一重大知识空白给研究人员开发有效的治疗方法带来了挑战。
宾夕法尼亚大学癌症生物学教授Xiaolu Yang博士说:“大多数生物体都有蛋白质质量控制系统,可以去除有缺陷的蛋白质,防止错误折叠和缠结的积累——就像我们在tau病患者的大脑中看到的tau蛋白一样,但直到现在,我们还不知道这在人类中是如何起作用的,或者为什么它在一些个体中不起作用,而在另一些个体中不起作用。我们第一次确定了监督tau功能的基因,并且有了一个有希望的目标,可以开发治疗方法来预防和减缓阿尔茨海默病和其他相关疾病的进展。”
Yang和他的团队,包括第一作者Zi-Yang Zhang博士,之前发现TRIM蛋白在动物细胞的蛋白质质量控制中起着重要作用。在检查了70多个人类TRIMs后,他们发现TRIM11在抑制tau聚集方面起着重要作用。TRIM11具有与tau蛋白质量控制相关的三个主要功能。首先,它与tau蛋白结合,尤其是导致疾病的突变变体,并帮助消除它们。其次,它充当tau蛋白的“伴侣”,防止蛋白质错误折叠。最后,TRIM11溶解预先存在的tau聚集体。
研究人员利用23名阿尔茨海默病患者的死后脑组织和14名来自神经退行性疾病研究中心组织库的健康对照者进行了验证,发现与健康对照者相比,阿尔茨海默病患者大脑中的TRIM11蛋白水平显著降低。
为了确定TRIM11作为治疗药物的潜在效用,研究人员使用腺相关病毒载体(AAV),一种基因治疗中常用的工具,将TRIM11基因传递到多种小鼠模型的大脑中。研究人员发现,接受TRIM11基因的tau病变小鼠,nft的发育和积累明显减少,认知和运动能力大大提高。

图2 TRIM11在AD脑中的抑制作用及其修复的潜在治疗益处
Yang说:“这些发现不仅告诉我们TRIM11可以在保护人们免受阿尔茨海默氏症和类似疾病方面发挥重要作用,而且我们还看到,我们可能能够开发出未来的治疗方法,在较低水平的个体中补充TRIM11。我们渴望与我们的同事一起探索开发基因疗法的可能性,以阻止神经退行性疾病的进展。”
本研究由美国国立卫生研究院(R01CA243520, UL1TR000003)支持,宾夕法尼亚大学根据与财富战略控股有限公司的赞助研究协议获得资助。
参考资料:
[1] TRIM11 protects against tauopathies and is down-regulated in Alzheimer's disease



