摘要:一项新研究的惊人结果提供了关于癌细胞如何转移的新见解,并提出了阻止其扩散的新治疗方法。
南加州大学(University of Southern California)的科学家领导的一项研究得出了令人惊讶的结果,为了解癌细胞如何转移提供了新的见解,同时也提出了阻止癌细胞扩散的新治疗方法。
美国国立卫生研究院支持的这项研究集中在一种叫做GRP78的细胞伴侣蛋白上,这种蛋白也被称为BiP,它有助于调节其他蛋白质的折叠。该团队由南加州大学凯克医学院生物化学和分子医学教授Amy S. Lee博士领导,以之前的工作为基础。研究人员使用共聚焦显微镜和mRNA敲除等技术表明,通常存在于细胞内质网(ER)的GRP78也可以在细胞应激时进入细胞核,在那里它调节基因表达和途径,最终使癌细胞变得更具攻击性。
该研究的资深作者、南加州大学诺里斯综合癌症中心朱迪和拉里·弗里曼基础科学研究主席Lee说:“在细胞核中发现GRP78控制基因表达完全是一个惊喜。当谈到癌细胞的基本机制时,这是一种新奇的东西,据我所知,以前没有人观察到过。”这一发现可能代表了细胞生物学的范式转变,并对癌症治疗研究具有启示意义。Lee及其同事在《美国国家科学院院刊》(PNAS)上发表了他们的研究结果,论文题为“ER伴侣GRP78/BiP在应激下易位到细胞核,并作为转录调节因子”,他们得出结论,“我们的研究揭示了癌细胞通过核GRP78介导的转录调节来响应ER应激的机制,从而采取侵袭性表型。”

图1 研究发现通常存在于细胞内质网(ER)的GRP78也可以在细胞应激时进入细胞核
作者指出,分子伴侣越来越被认为是健康和疾病中细胞稳态的主要调节者。由HSPA5基因编码的伴侣蛋白GRP78是热休克蛋白70 (HSP70)蛋白家族的成员。与其他细胞质HSP成员不同,GRP78包含一个将其靶向内质网的信号序列。作为一种主要的内质网伴侣,GRP78在折叠和加工膜结合蛋白或分泌蛋白中起着关键作用,Lee的团队之前的研究也表明,当细胞受到COVID-19或癌症的压力时,GRP78被劫持,允许病毒入侵者复制,癌症生长并抵抗治疗。
通过他们的新研究,南加州大学的研究人员意外发现,当细胞受到压力时,“在癌细胞中通常过度表达”的GRP78迁移到细胞核,在那里它改变了基因活动,改变了细胞的行为,使癌细胞变得更具移动性和侵袭性。
这项新发现最初是偶然发现的。Lee博士实验室的博士后研究员、该研究的第一作者Ze Liu博士正在分析GRP78如何调节一种被称为EGFR的基因,这种基因长期以来一直与癌症有关。Liu发现了一些令人惊讶的事情:GRP78控制着EGFR的基因活性,这提出了一种有趣的可能性,尽管GRP78长期以来被认为主要存在于细胞的内质网中,但伴侣蛋白可能已经进入细胞核并承担了新的角色。
为了证实他们的假设,Liu, Lee和同事使用共聚焦显微镜,提供高分辨率的2D和3D成像,再加上捕捉活细胞图像的先进技术,直接观察肺癌细胞细胞核中的GRP78,以及应激下的正常细胞。
研究人员还开始更多地了解GRP78进入细胞核后细胞内发生的事情。他们使用一种复杂的RNA测序方法,将细胞核中过度表达GRP78的肺癌细胞与细胞核中缺乏GRP78的细胞进行了比较,以帮助找出哪些基因受到了影响。“令我们非常惊讶的是,我们发现细胞核中受GRP78调控的关键基因主要与细胞迁移和入侵有关,”Lee说。“这项研究揭示了癌细胞通过GRP78/BiP的核易位对应激作出反应的分子机制,GRP78/BiP作为转录调节因子,允许细胞采用侵袭性表型并影响其他途径。”他们还指出,GRO78在多种癌症中上调,并与侵袭性生长、侵袭性和治疗耐药性有关。
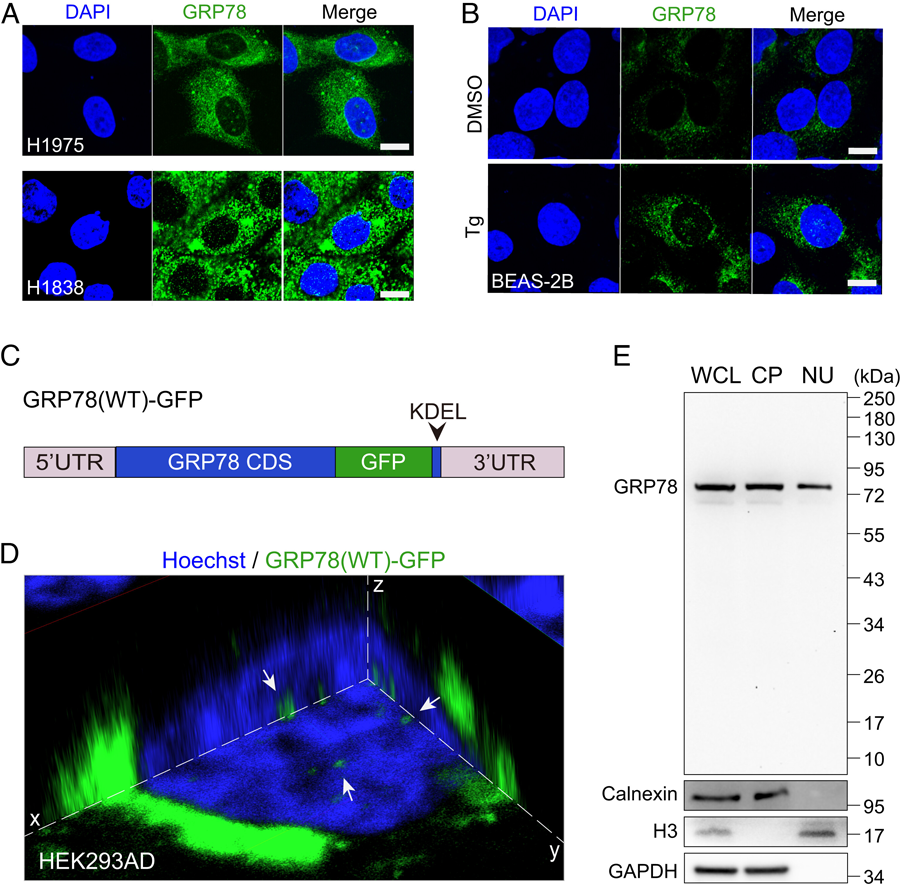
图2 GRP78定位于人癌症细胞和内质网应激细胞的细胞核。
他们使用了几种技术,包括生化分析和GRP78的mRNA敲除,这使他们能够识别GRP78内的信号,使其能够进入细胞核,并确认当GRP78存在于细胞核中时,它会刺激EGFR基因的活性。众所周知,EGFR在许多不同类型的癌症(包括肺癌)的肿瘤发生、增殖、生存和转移中发挥着多种作用。他们写道:“……我们发现GRP78敲低持续抑制多种人类肺癌细胞系中EGFR蛋白表达水平,这些细胞系具有不同的EGFR突变和扩增状态。”当他们查看200多种不同人类肺癌细胞系的基因表达数据库时,“我们发现GRP78和EGFR转录水平之间存在统计学上显著的正相关。”
他们的研究结果表明,GRP78与另一种通常抑制基因(包括EGFR)的细胞蛋白ID2结合,其中许多基因允许细胞迁移。但是当与GRP78结合时,ID2就不能再发挥作用了。研究小组写道:“核GRP78可以通过与转录抑制因子ID2的相互作用和抑制活性来调节基因和途径的表达,特别是那些对细胞迁移和入侵很重要的基因和途径。”如果没有ID2转录抑制因子的活性,癌细胞就会变得更具侵袭性。有趣的是,研究人员指出,“最近有报道称,ID2通过影响癌细胞的侵袭和迁移,在肺癌中发挥肿瘤抑制作用。”
新的结果指出了几种潜在的癌症治疗方法,包括下调GPR78的活性以抑制肺癌中的EGFR,或阻止GRP78与ID2结合。他们还评论说,他们的研究结果表明,GRP78/BiP抑制剂可能提供一种抑制各种人类肺癌细胞中EGFR的治疗方法,而没有针对特定突变的限制。
虽然目前的研究分析了肺癌细胞,但GRP78在包括胰腺癌、乳腺癌和结肠癌在内的各种类型的癌症中起着类似的作用。因此,GRP78也有可能与细胞核中对癌症至关重要的其他蛋白质结合,为癌症生物学开辟了一条新的研究方向。“此外,除了ID2之外,可能还有其他与核GRP78相互作用的伙伴,以及其他有待探索的机制,”他们指出。
GRP78可以进入细胞核并发挥新功能的发现可能在整个细胞生物学领域具有广泛的意义。Lee说,这是可能的——甚至是可能的——通常存在于细胞某一部分的其他蛋白质,在压力或其他触发下,可以迁移到细胞的另一部分,并以多种方式改变细胞的行为。“这是一个新概念,”她说。“蛋白质本身就是完成这项工作的士兵,但现在我们认为这不仅仅是士兵的问题,还包括士兵被部署在哪里。”
Lee和她的团队也在研究抑制GRP78表达或活性的药物。他们正在进行的一项研究表明,抑制GRP78的小分子,如YUM70,甚至可能能够阻断细胞核中GRP78的活性。
参考资料:
[1] ER chaperone GRP78/BiP translocates to the nucleus under stress and acts as a transcriptional regulator
摘要:一项新研究的惊人结果提供了关于癌细胞如何转移的新见解,并提出了阻止其扩散的新治疗方法。
南加州大学(University of Southern California)的科学家领导的一项研究得出了令人惊讶的结果,为了解癌细胞如何转移提供了新的见解,同时也提出了阻止癌细胞扩散的新治疗方法。
美国国立卫生研究院支持的这项研究集中在一种叫做GRP78的细胞伴侣蛋白上,这种蛋白也被称为BiP,它有助于调节其他蛋白质的折叠。该团队由南加州大学凯克医学院生物化学和分子医学教授Amy S. Lee博士领导,以之前的工作为基础。研究人员使用共聚焦显微镜和mRNA敲除等技术表明,通常存在于细胞内质网(ER)的GRP78也可以在细胞应激时进入细胞核,在那里它调节基因表达和途径,最终使癌细胞变得更具攻击性。
该研究的资深作者、南加州大学诺里斯综合癌症中心朱迪和拉里·弗里曼基础科学研究主席Lee说:“在细胞核中发现GRP78控制基因表达完全是一个惊喜。当谈到癌细胞的基本机制时,这是一种新奇的东西,据我所知,以前没有人观察到过。”这一发现可能代表了细胞生物学的范式转变,并对癌症治疗研究具有启示意义。Lee及其同事在《美国国家科学院院刊》(PNAS)上发表了他们的研究结果,论文题为“ER伴侣GRP78/BiP在应激下易位到细胞核,并作为转录调节因子”,他们得出结论,“我们的研究揭示了癌细胞通过核GRP78介导的转录调节来响应ER应激的机制,从而采取侵袭性表型。”

图1 研究发现通常存在于细胞内质网(ER)的GRP78也可以在细胞应激时进入细胞核
作者指出,分子伴侣越来越被认为是健康和疾病中细胞稳态的主要调节者。由HSPA5基因编码的伴侣蛋白GRP78是热休克蛋白70 (HSP70)蛋白家族的成员。与其他细胞质HSP成员不同,GRP78包含一个将其靶向内质网的信号序列。作为一种主要的内质网伴侣,GRP78在折叠和加工膜结合蛋白或分泌蛋白中起着关键作用,Lee的团队之前的研究也表明,当细胞受到COVID-19或癌症的压力时,GRP78被劫持,允许病毒入侵者复制,癌症生长并抵抗治疗。
通过他们的新研究,南加州大学的研究人员意外发现,当细胞受到压力时,“在癌细胞中通常过度表达”的GRP78迁移到细胞核,在那里它改变了基因活动,改变了细胞的行为,使癌细胞变得更具移动性和侵袭性。
这项新发现最初是偶然发现的。Lee博士实验室的博士后研究员、该研究的第一作者Ze Liu博士正在分析GRP78如何调节一种被称为EGFR的基因,这种基因长期以来一直与癌症有关。Liu发现了一些令人惊讶的事情:GRP78控制着EGFR的基因活性,这提出了一种有趣的可能性,尽管GRP78长期以来被认为主要存在于细胞的内质网中,但伴侣蛋白可能已经进入细胞核并承担了新的角色。
为了证实他们的假设,Liu, Lee和同事使用共聚焦显微镜,提供高分辨率的2D和3D成像,再加上捕捉活细胞图像的先进技术,直接观察肺癌细胞细胞核中的GRP78,以及应激下的正常细胞。
研究人员还开始更多地了解GRP78进入细胞核后细胞内发生的事情。他们使用一种复杂的RNA测序方法,将细胞核中过度表达GRP78的肺癌细胞与细胞核中缺乏GRP78的细胞进行了比较,以帮助找出哪些基因受到了影响。“令我们非常惊讶的是,我们发现细胞核中受GRP78调控的关键基因主要与细胞迁移和入侵有关,”Lee说。“这项研究揭示了癌细胞通过GRP78/BiP的核易位对应激作出反应的分子机制,GRP78/BiP作为转录调节因子,允许细胞采用侵袭性表型并影响其他途径。”他们还指出,GRO78在多种癌症中上调,并与侵袭性生长、侵袭性和治疗耐药性有关。

图2 GRP78定位于人癌症细胞和内质网应激细胞的细胞核。
他们使用了几种技术,包括生化分析和GRP78的mRNA敲除,这使他们能够识别GRP78内的信号,使其能够进入细胞核,并确认当GRP78存在于细胞核中时,它会刺激EGFR基因的活性。众所周知,EGFR在许多不同类型的癌症(包括肺癌)的肿瘤发生、增殖、生存和转移中发挥着多种作用。他们写道:“……我们发现GRP78敲低持续抑制多种人类肺癌细胞系中EGFR蛋白表达水平,这些细胞系具有不同的EGFR突变和扩增状态。”当他们查看200多种不同人类肺癌细胞系的基因表达数据库时,“我们发现GRP78和EGFR转录水平之间存在统计学上显著的正相关。”
他们的研究结果表明,GRP78与另一种通常抑制基因(包括EGFR)的细胞蛋白ID2结合,其中许多基因允许细胞迁移。但是当与GRP78结合时,ID2就不能再发挥作用了。研究小组写道:“核GRP78可以通过与转录抑制因子ID2的相互作用和抑制活性来调节基因和途径的表达,特别是那些对细胞迁移和入侵很重要的基因和途径。”如果没有ID2转录抑制因子的活性,癌细胞就会变得更具侵袭性。有趣的是,研究人员指出,“最近有报道称,ID2通过影响癌细胞的侵袭和迁移,在肺癌中发挥肿瘤抑制作用。”
新的结果指出了几种潜在的癌症治疗方法,包括下调GPR78的活性以抑制肺癌中的EGFR,或阻止GRP78与ID2结合。他们还评论说,他们的研究结果表明,GRP78/BiP抑制剂可能提供一种抑制各种人类肺癌细胞中EGFR的治疗方法,而没有针对特定突变的限制。
虽然目前的研究分析了肺癌细胞,但GRP78在包括胰腺癌、乳腺癌和结肠癌在内的各种类型的癌症中起着类似的作用。因此,GRP78也有可能与细胞核中对癌症至关重要的其他蛋白质结合,为癌症生物学开辟了一条新的研究方向。“此外,除了ID2之外,可能还有其他与核GRP78相互作用的伙伴,以及其他有待探索的机制,”他们指出。
GRP78可以进入细胞核并发挥新功能的发现可能在整个细胞生物学领域具有广泛的意义。Lee说,这是可能的——甚至是可能的——通常存在于细胞某一部分的其他蛋白质,在压力或其他触发下,可以迁移到细胞的另一部分,并以多种方式改变细胞的行为。“这是一个新概念,”她说。“蛋白质本身就是完成这项工作的士兵,但现在我们认为这不仅仅是士兵的问题,还包括士兵被部署在哪里。”
Lee和她的团队也在研究抑制GRP78表达或活性的药物。他们正在进行的一项研究表明,抑制GRP78的小分子,如YUM70,甚至可能能够阻断细胞核中GRP78的活性。
参考资料:
[1] ER chaperone GRP78/BiP translocates to the nucleus under stress and acts as a transcriptional regulator



