摘要:细菌用来转移基因的超聚合物结构也可以在未来医学中用于精确的药物输送。
肠道细菌形成称为F-pili的细胞外附属物,相互连接并传递称为基因的DNA包,使它们能够抵抗抗生素。人们认为,人类和动物肠道内的恶劣条件,包括湍流、热量和酸,会破坏F-pili,使转移更加困难。
然而,由伦敦帝国理工学院的研究人员领导的一个研究小组的新研究表明,在这些条件下,F-pili实际上更强壮,帮助细菌更有效地转移抗性基因,并聚集成“生物膜”——保护性细菌联合体——帮助它们抵御抗生素。这一发现说明了为什么对付耐药细菌如此困难,但确实为解决这一问题提供了一条可能的途径。细菌用来转移基因的超聚合物结构也可以在未来医学中用于精确的药物输送。研究结果发表在《Nature Communications》杂志上。

图1 研究发现F-pili帮助细菌更有效地转移抗性基因并聚集成“生物膜”
不同种类的细菌使用不同类型的pili在称为结合的过程中转移基因。一个经典的实验似乎表明,这个过程是脆弱的,可能会被搅动打断,但这留下了一个谜:如果肠道如此脆弱,为什么这么多生活在恶劣条件下的细菌会使用这些系统?
因此,研究小组开始验证这一假设。通过摇动大肠杆菌,同时在接合过程中使用F-pili,他们发现搅拌实际上提高了细菌之间基因转移的效率。他们还观察到,在转移基因后,在摇晃的条件下,结合的细菌更容易聚集在一起形成生物膜,从而保护内部细菌免受周围抗生素分子的侵害。
为了确定F-pili是如何做到这一点的,研究小组对它们进行了强度测试,他们在一个台上安装了一个细菌,用“分子镊子”将一个玻璃珠连接到其中一个F-pili的末端,然后拉。F-pili被证明是高度弹性的,具有弹簧般的特性,可以防止它们断裂。
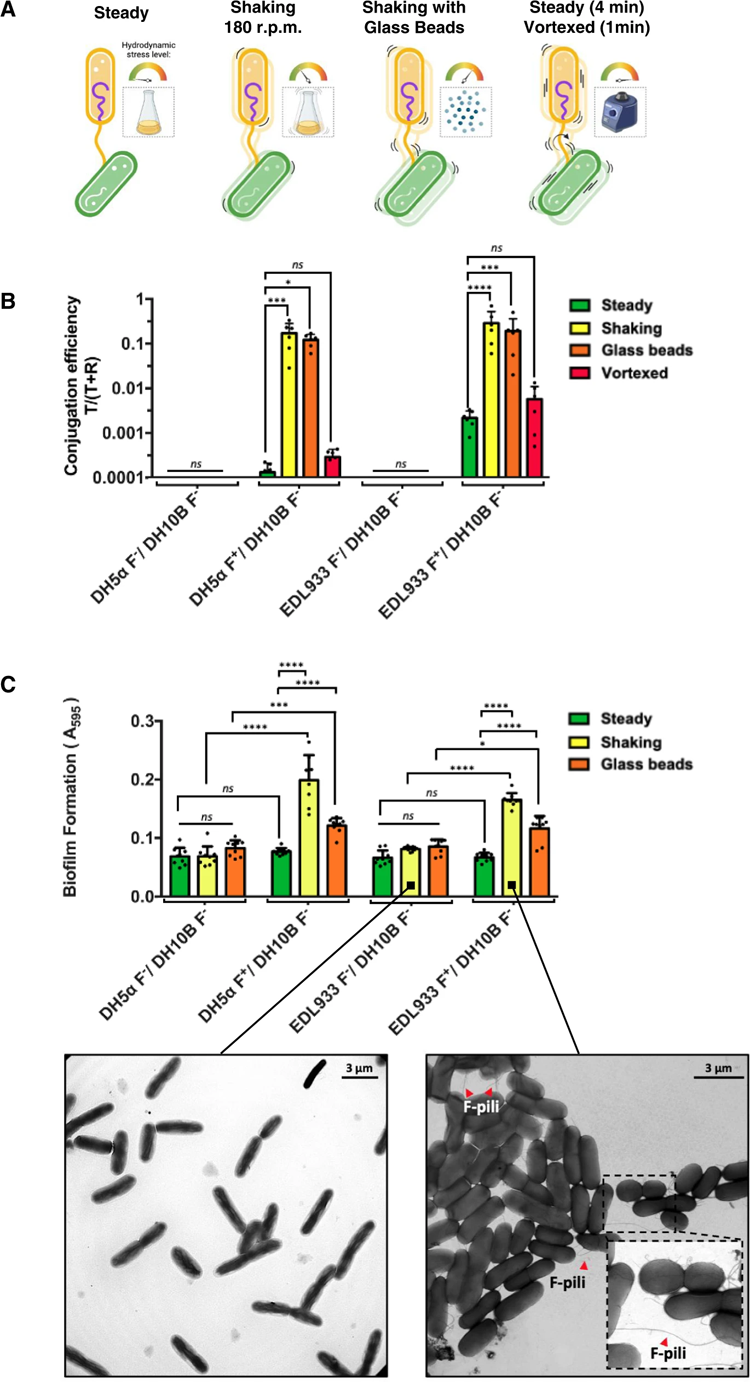
图2 机械应力对结合效率和生物膜形成的影响。
他们还测试了F-pili对其他常见肠道条件的承受能力,将它们置于氢氧化钠、尿素和100°C的高温下——所有这些条件下F-pili都存活了下来。
然后,研究小组进一步研究了F-pili,从分子水平上观察是什么赋予了它们这些令人难以置信的特性。它们主要由F-pilin“亚基”与相互连接的磷脂分子组成。
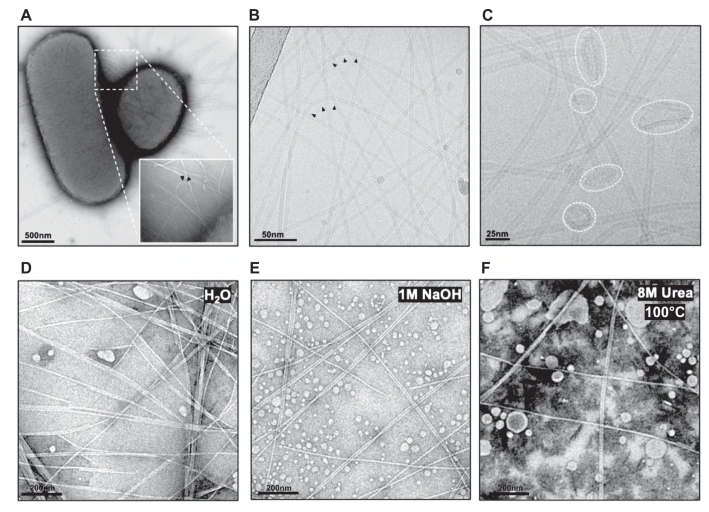
图3 完整细菌和纯化F-pili的电子显微镜显微照片
通过模拟没有磷脂的F-pili,研究小组展示了这些分子对结构的弹性和弹性强度有多重要。重复拉伸实验表明,亚基在没有磷脂支持的情况下迅速分解,证明了它们在长生物聚合物中作为“分子胶”的新作用。
来自帝国理工大学生命科学系的第一作者Jonasz Patkowski说:“到2050年,抗菌素耐药性导致的死亡人数预计将与癌症死亡人数持平,这意味着我们迫切需要新的策略来对抗这一趋势。耐药性的传播在很大程度上是由细菌交换基因驱动的,因此对这一过程的详细了解可能会导致中断它的新方法。很难找到具有如此强大性能的管状附属物。细菌利用它来转移基因,但如果我们能够模仿这些特性,我们就可以使用类似的结构来精确地将药物输送到体内需要的地方”
来自帝国理工大学生命科学系的首席研究员Tiago Costa博士说:“就资源和能量而言,制造F-pili对细菌来说是非常昂贵的,所以它们值得付出努力也就不足为奇了。我们已经展示了F-pili如何在动荡的环境中加速抗生素耐药性的传播和生物膜的形成,但现在的挑战是找到对抗这一非常有效的过程的方法。”
虽然破坏致病菌中的F-pili是有利的,但如果我们能将它们用于药物输送等方面,它们的特性可能会有所帮助。
参考资料:
[1] The F-pilus biomechanical adaptability accelerates conjugative dissemination of antimicrobial resistance and biofilm formation
摘要:细菌用来转移基因的超聚合物结构也可以在未来医学中用于精确的药物输送。
肠道细菌形成称为F-pili的细胞外附属物,相互连接并传递称为基因的DNA包,使它们能够抵抗抗生素。人们认为,人类和动物肠道内的恶劣条件,包括湍流、热量和酸,会破坏F-pili,使转移更加困难。
然而,由伦敦帝国理工学院的研究人员领导的一个研究小组的新研究表明,在这些条件下,F-pili实际上更强壮,帮助细菌更有效地转移抗性基因,并聚集成“生物膜”——保护性细菌联合体——帮助它们抵御抗生素。这一发现说明了为什么对付耐药细菌如此困难,但确实为解决这一问题提供了一条可能的途径。细菌用来转移基因的超聚合物结构也可以在未来医学中用于精确的药物输送。研究结果发表在《Nature Communications》杂志上。

图1 研究发现F-pili帮助细菌更有效地转移抗性基因并聚集成“生物膜”
不同种类的细菌使用不同类型的pili在称为结合的过程中转移基因。一个经典的实验似乎表明,这个过程是脆弱的,可能会被搅动打断,但这留下了一个谜:如果肠道如此脆弱,为什么这么多生活在恶劣条件下的细菌会使用这些系统?
因此,研究小组开始验证这一假设。通过摇动大肠杆菌,同时在接合过程中使用F-pili,他们发现搅拌实际上提高了细菌之间基因转移的效率。他们还观察到,在转移基因后,在摇晃的条件下,结合的细菌更容易聚集在一起形成生物膜,从而保护内部细菌免受周围抗生素分子的侵害。
为了确定F-pili是如何做到这一点的,研究小组对它们进行了强度测试,他们在一个台上安装了一个细菌,用“分子镊子”将一个玻璃珠连接到其中一个F-pili的末端,然后拉。F-pili被证明是高度弹性的,具有弹簧般的特性,可以防止它们断裂。

图2 机械应力对结合效率和生物膜形成的影响。
他们还测试了F-pili对其他常见肠道条件的承受能力,将它们置于氢氧化钠、尿素和100°C的高温下——所有这些条件下F-pili都存活了下来。
然后,研究小组进一步研究了F-pili,从分子水平上观察是什么赋予了它们这些令人难以置信的特性。它们主要由F-pilin“亚基”与相互连接的磷脂分子组成。

图3 完整细菌和纯化F-pili的电子显微镜显微照片
通过模拟没有磷脂的F-pili,研究小组展示了这些分子对结构的弹性和弹性强度有多重要。重复拉伸实验表明,亚基在没有磷脂支持的情况下迅速分解,证明了它们在长生物聚合物中作为“分子胶”的新作用。
来自帝国理工大学生命科学系的第一作者Jonasz Patkowski说:“到2050年,抗菌素耐药性导致的死亡人数预计将与癌症死亡人数持平,这意味着我们迫切需要新的策略来对抗这一趋势。耐药性的传播在很大程度上是由细菌交换基因驱动的,因此对这一过程的详细了解可能会导致中断它的新方法。很难找到具有如此强大性能的管状附属物。细菌利用它来转移基因,但如果我们能够模仿这些特性,我们就可以使用类似的结构来精确地将药物输送到体内需要的地方”
来自帝国理工大学生命科学系的首席研究员Tiago Costa博士说:“就资源和能量而言,制造F-pili对细菌来说是非常昂贵的,所以它们值得付出努力也就不足为奇了。我们已经展示了F-pili如何在动荡的环境中加速抗生素耐药性的传播和生物膜的形成,但现在的挑战是找到对抗这一非常有效的过程的方法。”
虽然破坏致病菌中的F-pili是有利的,但如果我们能将它们用于药物输送等方面,它们的特性可能会有所帮助。
参考资料:
[1] The F-pilus biomechanical adaptability accelerates conjugative dissemination of antimicrobial resistance and biofilm formation



