摘要:奥地利科学院分子生物技术研究所创建用于模拟早期人类胚胎的人胚状体
人类的早期发展为胚胎和成年生命奠定了基础,但此领域仍然难以研究。一个解决方案来自于干细胞组织成类似于植入前胚胎的结构的能力——称之为胚细胞。2021年奥地利科学院分子生物技术研究所的Nicolas Rivron研究团队发表在Nature的一篇文章报道了一个用于模拟早期人类胚胎的人胚状体,该研究团队利用人多能干细胞构建了人胚泡样结构(胚状体)。作者鉴定出Hippo、TGF-β和ERK三个信号通路,抑制它们就能得到有效模拟正常胚泡发育(成功率>70%)和能形成正确细胞(成功率>97%)的胚状体。

图 2021年研究团队利用人多能干细胞构建了人胚泡样结构
在此基础上,该团队进一步描述了如何形成人类母细胞,这些母细胞可以(1)有效地实现囊胚的形态和(2)根据囊胚发育的速度和顺序形成谱系,(3) 最终形成转录反映囊胚的细胞(植入前阶段)。总之,母细胞提供了一个机会,可以为早孕建立科学和生物医学发现计划,并提供一种替代胚胎使用的伦理选择。
相关研究成果以“Generating human blastoids modeling blastocyst-stage embryos and implantation”为题于2023年2月15日发表在Nature Protocols上。

图 2023年研究团队描述了如何形成人类母细胞
01 抑制Hippo、ERK和TGFβ通路
在4 dpf时,孕体形成桑葚胚,启动空化形成囊胚。囊胚发育(5-7 dpf)支持三个创始谱系的产生:外胚层(EPI),它是胚胎的;滋养外胚层(TE),是胚外的;和原始内胚层 (PrE),它是胚外的(图1a)。外周细胞通过抑制 Hippo 通路变成TE。在PXGL2中培养的原始人多能干细胞(PSC)在抑制TGFβ和ERK通路后有效地形成TE类似物。该团队在非粘附水凝胶微孔中聚集初始PSC并抑制这三种途径(图1b)。在含有STAT激活剂白血病抑制因子(LIF)和Y-27632(一种 ROCK 抑制剂),囊胚样结构有效形成(图1c-e)。
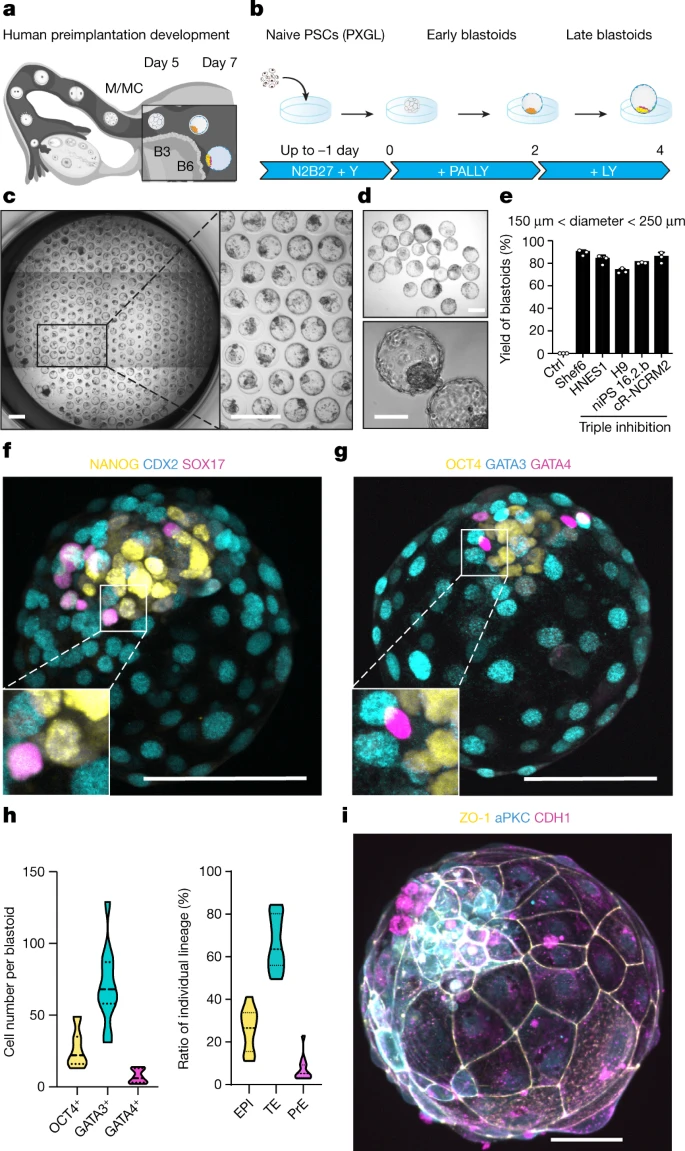
图1 三重抑制的幼稚 PSC 有效地形成了人类胚泡样结构,其中包含三个创始谱系的类似物
02 囊胚期类似物的形成
单细胞转录组学分析表明,胚泡样结构仅形成三种不同的转录组状态(图2a、b),由三个创始谱系特有的基因标记,包括GATA2和GATA3 (TE)、POU5F1和KLF17 (EPI),以及GATA4 和SOX17 (PrE)(图2c、d)。与来自胚泡、体外培养的胚泡和原肠胚形成期胚胎的细胞比较表明,胚泡样结构中的细胞在转录上与胚泡期相似并且不同于着床后阶段(图2e、f)。
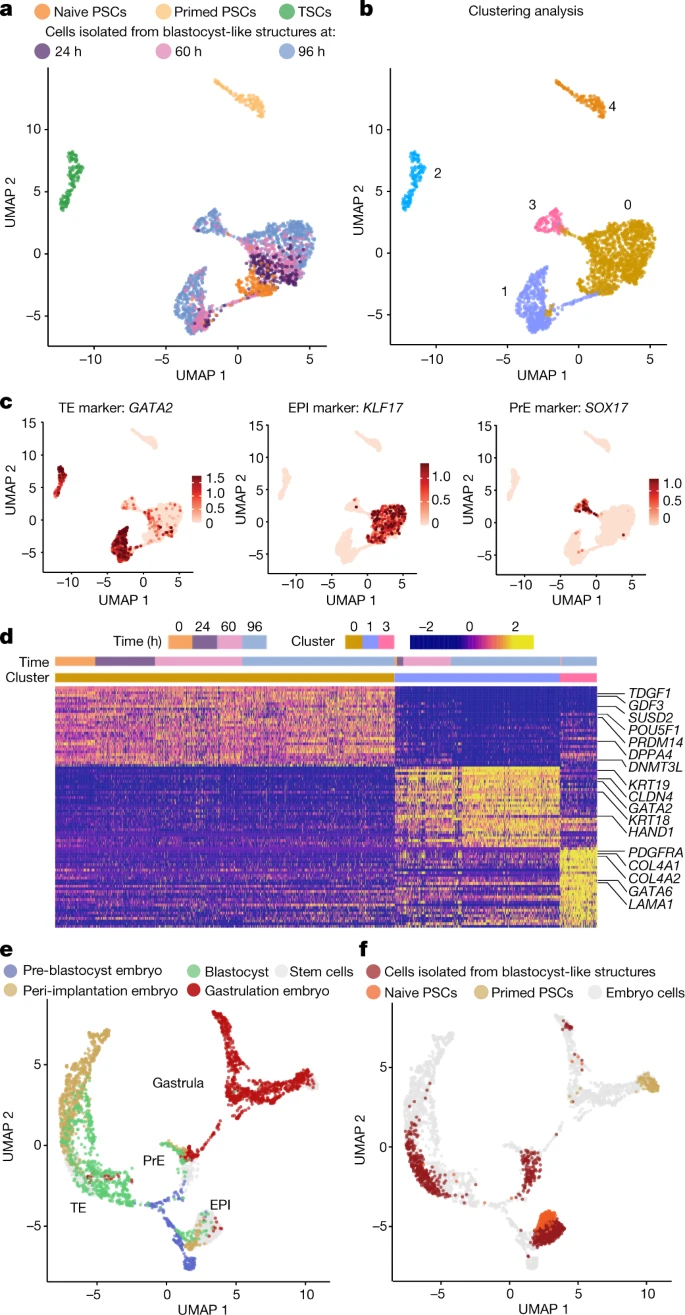
图2 人类胚泡样结构形成三种植入前谱系的类似物
03 Hippo抑制必不可少
关于人类囊胚谱系分离的知识是有限的(图3a)。然而,已知在获得顶端结构域后外周细胞中会发生Hippo通路的抑制,并且需要启动TE规范。因而作者测试了囊胚样结构是否采用了这种机制。值得注意的是,aPKC和F-肌动蛋白表达域在外部细胞中似乎是共同排列的,这些细胞也在细胞核中积累了Hippo下游效应子YAP1。YAP1核位置与GATA2和GATA3表达相关,与NANOG表达形成对比,并且仅限于TE类似物(图3b)。aPKC抑制剂可以抑制Hippo通路的LPA受体配体(LPA和NAEPA)增强了囊胚样结构的形成(图3c)。由于Hippo通路抑制释放YAP1进入细胞核,作者测试了YAP1的基因工程水平和功能是否会影响形态发生。YAP1 (5SA)的野生型或组成型活性形式的过表达加速了空化(图3d)。
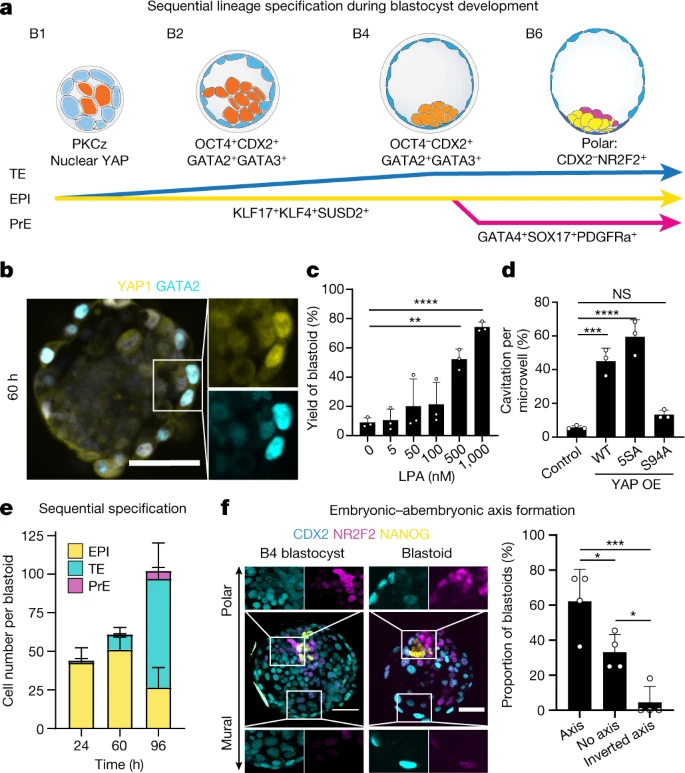
图3 根据囊胚发育的顺序和时间形成三个谱系
04 明显附着于子宫内膜细胞
在7 dpf时,人类囊胚通过其TE附着到接受性子宫内膜开始在子宫内着床(图4a)。作者测试了母细胞是否可以通过在2D中接种子宫内膜类器官来模拟这种相互作用,以形成一个开放的子宫内膜层(OFEL)以促进母细胞的沉积(图 4a)。沉积在未受刺激的OFEL上的母细胞没有附着;然而,它们确实附着并排斥受刺激的OFEL的子宫内膜细胞,就像在子宫内发生的那样(图4b)。由此得出结论人类母细胞能够与已经接受的子宫内膜细胞特异性相互作用。
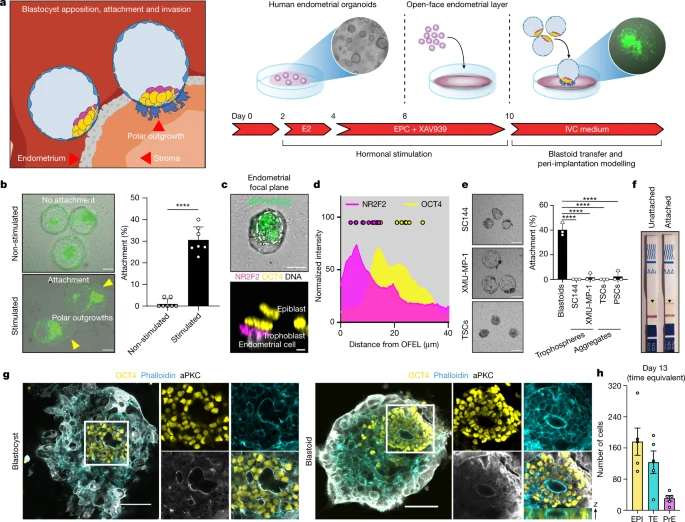
图4 人类母细胞概括了植入的各个方面
综上,人类母细胞在形态上类似于人类囊胚,有效地生成其三个谱系的类似物,其转录组与人类囊胚阶段相匹配,并根据序列(TE和EPI,然后是pTE和PrE)和近似速度形成这些类似物(4天)胚泡发育。
因此,作者建议该模型与人类囊胚发育和植入的研究相关。模拟外胚层和滋养外胚层之间的相互作用表明,外胚层诱导极地滋养外胚层的局部成熟并随后赋予它附着在受刺激的子宫内膜细胞上的能力。将来,人类胚细胞可用于帮助确定治疗靶点并有助于临床前建模(例如,体外受精培养基补充剂,如LPA和NAEPA或避孕药,如SC144)。考虑到人类胚胎学的相称性(平衡利弊)和辅助性(使用道德上问题最少的手段追求目标),胚细胞代表了一个伦理机会来补充使用胚胎的研究。
参考资料:
[1]Heidar Heidari Khoei, Alok Javali, Harunobu Kagawa, Theresa Maria Sommer, Giovanni Sestini, Laurent David, Jana Slovakova, Maria Novatchkova, Yvonne Scholte op Reimer & Nicolas Rivron, Generating human blastoids modeling blastocyst-stage embryos and implantation,Nature Protocols (2023)
[2]Harunobu Kagawa, Alok Javali, Heidar Heidari Khoei, Theresa Maria Sommer, Giovanni Sestini, Maria Novatchkova, Yvonne Scholte op Reimer, Gaël Castel, Alexandre Bruneau, Nina Maenhoudt, Jenna Lammers, Sophie Loubersac, Thomas Freour, Hugo Vankelecom, Laurent David & Nicolas Rivron, Human blastoids model blastocyst development and implantation, Nature volume 601, pages600–605 (2022)
[2]Harunobu Kagawa, Alok Javali, Heidar Heidari Khoei, Theresa Maria Sommer, Giovanni Sestini, Maria Novatchkova, Yvonne Scholte op Reimer, Gaël Castel, Alexandre Bruneau, Nina Maenhoudt, Jenna Lammers, Sophie Loubersac, Thomas Freour, Hugo Vankelecom, Laurent David & Nicolas Rivron, Human blastoids model blastocyst development and implantation, Nature volume 601, pages600–605 (2022)
摘要:奥地利科学院分子生物技术研究所创建用于模拟早期人类胚胎的人胚状体
人类的早期发展为胚胎和成年生命奠定了基础,但此领域仍然难以研究。一个解决方案来自于干细胞组织成类似于植入前胚胎的结构的能力——称之为胚细胞。2021年奥地利科学院分子生物技术研究所的Nicolas Rivron研究团队发表在Nature的一篇文章报道了一个用于模拟早期人类胚胎的人胚状体,该研究团队利用人多能干细胞构建了人胚泡样结构(胚状体)。作者鉴定出Hippo、TGF-β和ERK三个信号通路,抑制它们就能得到有效模拟正常胚泡发育(成功率>70%)和能形成正确细胞(成功率>97%)的胚状体。

图 2021年研究团队利用人多能干细胞构建了人胚泡样结构
在此基础上,该团队进一步描述了如何形成人类母细胞,这些母细胞可以(1)有效地实现囊胚的形态和(2)根据囊胚发育的速度和顺序形成谱系,(3) 最终形成转录反映囊胚的细胞(植入前阶段)。总之,母细胞提供了一个机会,可以为早孕建立科学和生物医学发现计划,并提供一种替代胚胎使用的伦理选择。
相关研究成果以“Generating human blastoids modeling blastocyst-stage embryos and implantation”为题于2023年2月15日发表在Nature Protocols上。

图 2023年研究团队描述了如何形成人类母细胞
01 抑制Hippo、ERK和TGFβ通路
在4 dpf时,孕体形成桑葚胚,启动空化形成囊胚。囊胚发育(5-7 dpf)支持三个创始谱系的产生:外胚层(EPI),它是胚胎的;滋养外胚层(TE),是胚外的;和原始内胚层 (PrE),它是胚外的(图1a)。外周细胞通过抑制 Hippo 通路变成TE。在PXGL2中培养的原始人多能干细胞(PSC)在抑制TGFβ和ERK通路后有效地形成TE类似物。该团队在非粘附水凝胶微孔中聚集初始PSC并抑制这三种途径(图1b)。在含有STAT激活剂白血病抑制因子(LIF)和Y-27632(一种 ROCK 抑制剂),囊胚样结构有效形成(图1c-e)。

图1 三重抑制的幼稚 PSC 有效地形成了人类胚泡样结构,其中包含三个创始谱系的类似物
02 囊胚期类似物的形成
单细胞转录组学分析表明,胚泡样结构仅形成三种不同的转录组状态(图2a、b),由三个创始谱系特有的基因标记,包括GATA2和GATA3 (TE)、POU5F1和KLF17 (EPI),以及GATA4 和SOX17 (PrE)(图2c、d)。与来自胚泡、体外培养的胚泡和原肠胚形成期胚胎的细胞比较表明,胚泡样结构中的细胞在转录上与胚泡期相似并且不同于着床后阶段(图2e、f)。

图2 人类胚泡样结构形成三种植入前谱系的类似物
03 Hippo抑制必不可少
关于人类囊胚谱系分离的知识是有限的(图3a)。然而,已知在获得顶端结构域后外周细胞中会发生Hippo通路的抑制,并且需要启动TE规范。因而作者测试了囊胚样结构是否采用了这种机制。值得注意的是,aPKC和F-肌动蛋白表达域在外部细胞中似乎是共同排列的,这些细胞也在细胞核中积累了Hippo下游效应子YAP1。YAP1核位置与GATA2和GATA3表达相关,与NANOG表达形成对比,并且仅限于TE类似物(图3b)。aPKC抑制剂可以抑制Hippo通路的LPA受体配体(LPA和NAEPA)增强了囊胚样结构的形成(图3c)。由于Hippo通路抑制释放YAP1进入细胞核,作者测试了YAP1的基因工程水平和功能是否会影响形态发生。YAP1 (5SA)的野生型或组成型活性形式的过表达加速了空化(图3d)。

图3 根据囊胚发育的顺序和时间形成三个谱系
04 明显附着于子宫内膜细胞
在7 dpf时,人类囊胚通过其TE附着到接受性子宫内膜开始在子宫内着床(图4a)。作者测试了母细胞是否可以通过在2D中接种子宫内膜类器官来模拟这种相互作用,以形成一个开放的子宫内膜层(OFEL)以促进母细胞的沉积(图 4a)。沉积在未受刺激的OFEL上的母细胞没有附着;然而,它们确实附着并排斥受刺激的OFEL的子宫内膜细胞,就像在子宫内发生的那样(图4b)。由此得出结论人类母细胞能够与已经接受的子宫内膜细胞特异性相互作用。

图4 人类母细胞概括了植入的各个方面
综上,人类母细胞在形态上类似于人类囊胚,有效地生成其三个谱系的类似物,其转录组与人类囊胚阶段相匹配,并根据序列(TE和EPI,然后是pTE和PrE)和近似速度形成这些类似物(4天)胚泡发育。
因此,作者建议该模型与人类囊胚发育和植入的研究相关。模拟外胚层和滋养外胚层之间的相互作用表明,外胚层诱导极地滋养外胚层的局部成熟并随后赋予它附着在受刺激的子宫内膜细胞上的能力。将来,人类胚细胞可用于帮助确定治疗靶点并有助于临床前建模(例如,体外受精培养基补充剂,如LPA和NAEPA或避孕药,如SC144)。考虑到人类胚胎学的相称性(平衡利弊)和辅助性(使用道德上问题最少的手段追求目标),胚细胞代表了一个伦理机会来补充使用胚胎的研究。
参考资料:
[1]Heidar Heidari Khoei, Alok Javali, Harunobu Kagawa, Theresa Maria Sommer, Giovanni Sestini, Laurent David, Jana Slovakova, Maria Novatchkova, Yvonne Scholte op Reimer & Nicolas Rivron, Generating human blastoids modeling blastocyst-stage embryos and implantation,Nature Protocols (2023)
[2]Harunobu Kagawa, Alok Javali, Heidar Heidari Khoei, Theresa Maria Sommer, Giovanni Sestini, Maria Novatchkova, Yvonne Scholte op Reimer, Gaël Castel, Alexandre Bruneau, Nina Maenhoudt, Jenna Lammers, Sophie Loubersac, Thomas Freour, Hugo Vankelecom, Laurent David & Nicolas Rivron, Human blastoids model blastocyst development and implantation, Nature volume 601, pages600–605 (2022)
[2]Harunobu Kagawa, Alok Javali, Heidar Heidari Khoei, Theresa Maria Sommer, Giovanni Sestini, Maria Novatchkova, Yvonne Scholte op Reimer, Gaël Castel, Alexandre Bruneau, Nina Maenhoudt, Jenna Lammers, Sophie Loubersac, Thomas Freour, Hugo Vankelecom, Laurent David & Nicolas Rivron, Human blastoids model blastocyst development and implantation, Nature volume 601, pages600–605 (2022)



