摘要:在一项新的研究中,耶鲁大学的研究人员发现了有益细菌在肠道定植的一种新的机制。
肠道中的微生物对人类健康至关重要,了解肠道中促进有益细菌种类(被称为“好”细菌)生长的因素可能使医疗干预措施能够促进肠道和整体人类健康。在一项新的研究中,耶鲁大学的研究人员发现了这些细菌在肠道定植的一种新的机制。
具体来说,耶鲁大学的研究小组发现,在人类肠道中发现的最丰富的有益物种之一,在经历碳源限制时,其定植潜力会增加——这一发现可能会产生新的临床干预措施,支持健康的肠道。研究结果发表在3月16日的《科学》杂志上。

图1 研究人员发现了有益细菌在肠道定植的一种新的机制
耶鲁大学的研究小组,由微生物致病学教授、遗传学家Eduardo Groisman的实验室组成,他们发现将有益的肠道细菌:拟杆菌(Bacteroides thetaotaomicron)中一种基本转录因子的部分隔离在无膜的隔室中,会对碳饥饿(所有细胞的主要组成部分)做出了反应。
研究小组确定,转录因子的隔离增加了其活性,从而改变了数百种细菌基因的表达,包括几个促进肠道定植和控制细菌中枢代谢途径的基因。这些发现揭示了“好”细菌将分子隔离到无膜的隔间中作为在哺乳动物肠道中定居的重要策略。
拟杆菌(Bacteroides thetaotaomicron)和其他生活在哺乳动物肠道中的细菌可以获得宿主动物摄入的营养物质。然而,也有很长一段时间,宿主生物不吃东西。研究人员发现,缺乏包括碳在内的营养物质会导致有益肠道细菌产生定植因子。
Groisman实验室的博士后、该研究的主要作者Aimilia Krypotou说:“其中会发生,当一个有机体缺乏碳时,这是一个信号,有助于产生有利于在肠道中生存的特性。”
该实验室之前研究的一系列观察结果带来了这一突破性进展。首先是当Groisman注意到来自肠道微生物的转录因子的大小比来自其他细菌物种的其他经过充分研究的同源蛋白要大得多。研究小组随后发现,如果没有同源蛋白缺失的额外区域,细菌就无法在小鼠肠道中存活。
然后,Krypotou假设额外的区域可能赋予细菌在肠道中生存所需的转录因子一种新的生物物理性质,并成功地进行了一系列实验来验证这一假设。
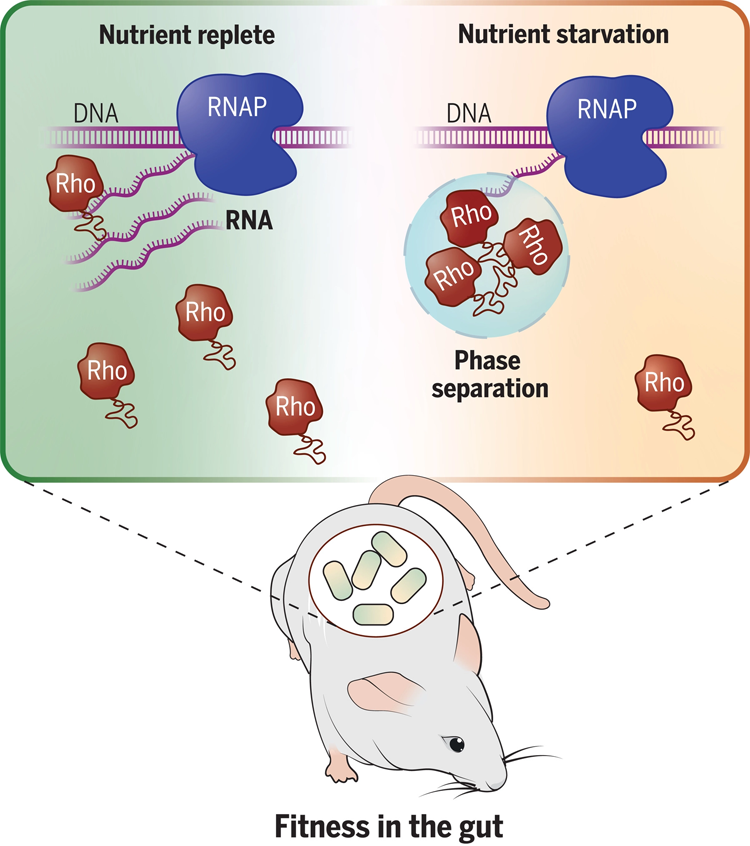
图2 共生细菌拟杆菌中转录终止因子Rho的相分离控制基因表达并促进哺乳动物肠道中的细菌适应性。
Groisman说,人们对这些无膜隔间的认识实际上可以追溯到一百年前。Krypotou的关键见解,他说,是根据额外的区域推断出细菌转录因子的新特性,称为Rho。转录因子的隔离是通过一种被称为液-液相分离的过程发生的,这是一种在包括人类在内的各种细胞中普遍存在的现象。
“这种现象已经被人们所知,但通常与植物、动物和真菌等真核生物的压力有关。最近我们意识到它也可以发生在细菌身上,在我们的案例中,我们确定它发生在共生肠道细菌中,共生肠道细菌需要它在肠道中生存。人们可以想象,如果有人操纵容易产生这种效应的生物体,也许就能改善对人类有益的生物体。”
Krypotou说,这一发现可能有助于促进肠道健康的新益生菌疗法的发展。
她说:“大多数研究只关注细菌的丰度。如果我们不了解分子水平上发生了什么,我们就不知道它是否有帮助。”
参考资料:
[1] Bacteria require phase separation for fitness in the mammalian gut
摘要:在一项新的研究中,耶鲁大学的研究人员发现了有益细菌在肠道定植的一种新的机制。
肠道中的微生物对人类健康至关重要,了解肠道中促进有益细菌种类(被称为“好”细菌)生长的因素可能使医疗干预措施能够促进肠道和整体人类健康。在一项新的研究中,耶鲁大学的研究人员发现了这些细菌在肠道定植的一种新的机制。
具体来说,耶鲁大学的研究小组发现,在人类肠道中发现的最丰富的有益物种之一,在经历碳源限制时,其定植潜力会增加——这一发现可能会产生新的临床干预措施,支持健康的肠道。研究结果发表在3月16日的《科学》杂志上。

图1 研究人员发现了有益细菌在肠道定植的一种新的机制
耶鲁大学的研究小组,由微生物致病学教授、遗传学家Eduardo Groisman的实验室组成,他们发现将有益的肠道细菌:拟杆菌(Bacteroides thetaotaomicron)中一种基本转录因子的部分隔离在无膜的隔室中,会对碳饥饿(所有细胞的主要组成部分)做出了反应。
研究小组确定,转录因子的隔离增加了其活性,从而改变了数百种细菌基因的表达,包括几个促进肠道定植和控制细菌中枢代谢途径的基因。这些发现揭示了“好”细菌将分子隔离到无膜的隔间中作为在哺乳动物肠道中定居的重要策略。
拟杆菌(Bacteroides thetaotaomicron)和其他生活在哺乳动物肠道中的细菌可以获得宿主动物摄入的营养物质。然而,也有很长一段时间,宿主生物不吃东西。研究人员发现,缺乏包括碳在内的营养物质会导致有益肠道细菌产生定植因子。
Groisman实验室的博士后、该研究的主要作者Aimilia Krypotou说:“其中会发生,当一个有机体缺乏碳时,这是一个信号,有助于产生有利于在肠道中生存的特性。”
该实验室之前研究的一系列观察结果带来了这一突破性进展。首先是当Groisman注意到来自肠道微生物的转录因子的大小比来自其他细菌物种的其他经过充分研究的同源蛋白要大得多。研究小组随后发现,如果没有同源蛋白缺失的额外区域,细菌就无法在小鼠肠道中存活。
然后,Krypotou假设额外的区域可能赋予细菌在肠道中生存所需的转录因子一种新的生物物理性质,并成功地进行了一系列实验来验证这一假设。

图2 共生细菌拟杆菌中转录终止因子Rho的相分离控制基因表达并促进哺乳动物肠道中的细菌适应性。
Groisman说,人们对这些无膜隔间的认识实际上可以追溯到一百年前。Krypotou的关键见解,他说,是根据额外的区域推断出细菌转录因子的新特性,称为Rho。转录因子的隔离是通过一种被称为液-液相分离的过程发生的,这是一种在包括人类在内的各种细胞中普遍存在的现象。
“这种现象已经被人们所知,但通常与植物、动物和真菌等真核生物的压力有关。最近我们意识到它也可以发生在细菌身上,在我们的案例中,我们确定它发生在共生肠道细菌中,共生肠道细菌需要它在肠道中生存。人们可以想象,如果有人操纵容易产生这种效应的生物体,也许就能改善对人类有益的生物体。”
Krypotou说,这一发现可能有助于促进肠道健康的新益生菌疗法的发展。
她说:“大多数研究只关注细菌的丰度。如果我们不了解分子水平上发生了什么,我们就不知道它是否有帮助。”
参考资料:
[1] Bacteria require phase separation for fitness in the mammalian gut



