摘要:一项利用CRISPR/Cas9探索一些巨型病毒进化起源的研究发现,它们的大基因组源于基因复制。
大多数病毒都很小,携带最简单的基因组。即使是最大的小型病毒之一,牛痘病毒,也只有花粉粒的五十分之一大小,只含有270个基因。巨型病毒藐视这些规则。它们的大小可与小型细菌相媲美,基因组包含数千个基因,其复杂性堪比细胞生命。这些病毒如何变得如此庞大一直是争论的主题。现在,科学家们终于准备好解开它们的进化起源之谜,这要归功于《Nature Communications》1月份一篇论文中描述的一套基于CRISPR/Cas9的工具。
法国艾克斯-马赛大学的病毒学家Chantal Abergel说:“我们遇到第一个巨型病毒是偶然的。它是Mimivirus,实际上它被误认为是一种细菌。”在这一发现之后的20年里,病毒学家一直优先探索巨型病毒的多样性。现在他们已经发现了一些,重点已经转移到用分子生物学技术更详细地研究它们的进化。

图1 科学家推断复杂的病毒起源于更小更简单的病毒(图源:[1])
进化生物学家一直在努力研究巨型病毒的两种可能起源。一种可能性是,它们曾经是细胞生物,随着时间的推移,在物理上和基因上都缩小了。但是大多数病毒学家现在怀疑巨型病毒是由小得多的病毒进化而来的——尽管支持这两种假设的证据都很缺乏。
为了解决这个起源问题,Abergel决定研究Pandoravirus基因组中的基本基因是如何分布的。在细胞生物中,基本基因分散在整个基因组中,所以如果巨型病毒本质上是缩小的细胞,人们就会期望类似的模式。或者,如果基因是聚集的,这可能表明病毒的大基因组一开始以更紧凑的形式出现。
找到病毒必需基因的一种方法是一次敲除一个基因,以找到病毒产生所需的基因。但要用巨型病毒做到这一点,Abergel需要一个在群体成员中起作用的基因编辑系统。在Abergel实验室博士后研究员Hugo Bisio和艾克斯-马赛大学同事的帮助下,Abergel使用了基于CRISPR/Cas9的基因编辑系统,修改了Acanthamoeba castellanii和感染它的巨型病毒Pandoravirus neocaledonia的基因组。
CRISPR/Cas9系统被设计用于删除特定基因,由两个引导RNA和一个Cas9分裂酶组成。与其他CRISPR/Cas9系统类似,每个引导RNA包含17到20个碱基,被设计成与巨型病毒或变形虫基因组上的一个特定位置结合,允许Cas9分裂酶在该位置切割基因组。
Acanthamoeba castellanii每条染色体包含25个副本,这使得设计一个可以删除每个基因副本的有效CRISPR/Cas9系统变得困难。为了克服这个问题,研究人员修改了他们的CRISPR/Cas9系统,以产生链式反应。每当DNA被切割以去除一个基因时,编码Cas9酶的DNA片段和负责切割的引导RNA将取代基因组中缺失的基因。这使得基因删除重复和传播,直到所有副本被删除。
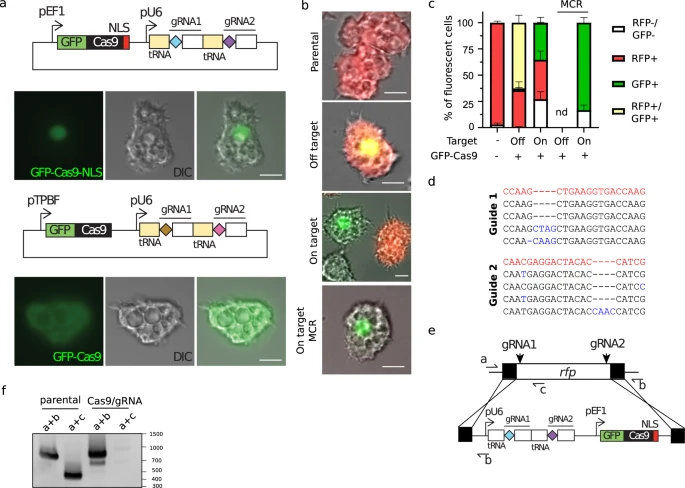
图2 CRISPR/Cas9操作卡氏棘阿米巴(图源:[1])
复杂的病毒起源于更小更简单的病毒
一旦他们优化了CRISPR/Cas9系统,团队就从Pandoravirus基因组中分别删除了每个基因,并测量了由此产生的病毒生产变化,以确定每个基因对病毒生命周期的重要性。他们发现,必需基因聚集在基因组的一端,与非必需基因在另一端分离。比西奥说,在病毒中还没有发现过这种水平的基因有序性。即使是细菌基因组也不那么整齐:虽然它们确实将功能相连的基因分组成称为操纵子的基因簇,但这些基因簇往往分散在整个基因组中,而不是集中在一个点上。
必需基因簇可能与一种古老病毒的较小的“核心基因组”相呼应。这个基因组可能通过多轮偏向一个方向的基因复制而被拉长,以产生额外的一组多余的非必需基因。这可以解释现代巨型病毒是如何拥有数千个基因的。
作者指出“我们的数据表明,复杂病毒起源于更小、更简单的病毒,”需要进一步研究才能确定这是否适用于所有巨型病毒,还是仅仅适用于Pandoravirus。其他研究发现,巨型病毒中的一些基因是从它们的Acanthamoeba castellanii宿主那里篡夺的,这表明基因交换是巨型病毒增大体积的另一种方式。
研究小组随后将目光投向Pandoravirus的众多进化之谜之一:它没有衣壳。小病毒将它们的基因组包装成由病毒蛋白质构成的衣壳。虽然一些巨型病毒,如Mimivirus,延续了这一传统,但其他病毒,包括Pandoravirus病毒,却没有。如果巨型病毒确实是从较小的病毒进化而来,那么它们的基因组中可能隐藏着衣壳蛋白质的痕迹。因此,研究人员开始研究Pandoravirus病毒的近亲——较小的Mollivirus——潜在衣壳蛋白残余的功能,这种病毒也可以感染A. castellanii。
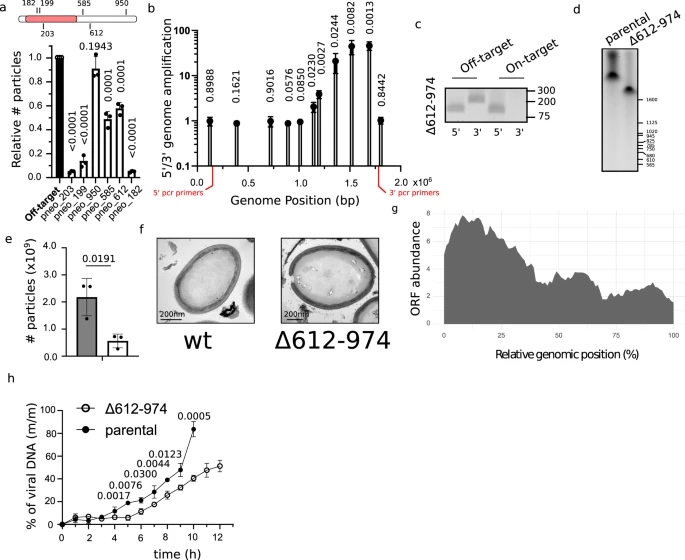
图3 潘多拉病毒基因组保留了其较小祖先的痕迹(图源:[1])
研究人员根据其基因序列和预测的3D形状,怀疑一种名为ml_347的Mollivirus蛋白质是从衣壳基因进化而来的。因此,该团队通过使用CRISPR/Cas9系统删除该基因来研究其功能。他们发现该基因对Mollivirus的组装很重要,作者说考虑到它可能的衣壳血统,这很有趣。有可能,随着衣壳在巨型病毒进化中丢失,过时的衣壳基因被适应了新的组装功能。
加州能源部联合基因组研究所的进化生物学家Frederik Schulz点评:看到CRISPR/Cas9技术被引入其他宿主物种(如藻类)将是令人兴奋的,这将允许研究人员将研究扩大到更多种类的巨型病毒。他还指出,该系统只适用于在宿主细胞核中复制的病毒,而大多数巨型病毒复制在被称为病毒工厂的细胞质结构中,Cas9酶和引导RNA无法穿透。
CRISPR/Cas9技术将用来梳理所有病毒基因的功能。
参考资料:
[1] Evolution of giant pandoravirus revealed by CRISPR/Cas9
摘要:一项利用CRISPR/Cas9探索一些巨型病毒进化起源的研究发现,它们的大基因组源于基因复制。
大多数病毒都很小,携带最简单的基因组。即使是最大的小型病毒之一,牛痘病毒,也只有花粉粒的五十分之一大小,只含有270个基因。巨型病毒藐视这些规则。它们的大小可与小型细菌相媲美,基因组包含数千个基因,其复杂性堪比细胞生命。这些病毒如何变得如此庞大一直是争论的主题。现在,科学家们终于准备好解开它们的进化起源之谜,这要归功于《Nature Communications》1月份一篇论文中描述的一套基于CRISPR/Cas9的工具。
法国艾克斯-马赛大学的病毒学家Chantal Abergel说:“我们遇到第一个巨型病毒是偶然的。它是Mimivirus,实际上它被误认为是一种细菌。”在这一发现之后的20年里,病毒学家一直优先探索巨型病毒的多样性。现在他们已经发现了一些,重点已经转移到用分子生物学技术更详细地研究它们的进化。

图1 科学家推断复杂的病毒起源于更小更简单的病毒(图源:[1])
进化生物学家一直在努力研究巨型病毒的两种可能起源。一种可能性是,它们曾经是细胞生物,随着时间的推移,在物理上和基因上都缩小了。但是大多数病毒学家现在怀疑巨型病毒是由小得多的病毒进化而来的——尽管支持这两种假设的证据都很缺乏。
为了解决这个起源问题,Abergel决定研究Pandoravirus基因组中的基本基因是如何分布的。在细胞生物中,基本基因分散在整个基因组中,所以如果巨型病毒本质上是缩小的细胞,人们就会期望类似的模式。或者,如果基因是聚集的,这可能表明病毒的大基因组一开始以更紧凑的形式出现。
找到病毒必需基因的一种方法是一次敲除一个基因,以找到病毒产生所需的基因。但要用巨型病毒做到这一点,Abergel需要一个在群体成员中起作用的基因编辑系统。在Abergel实验室博士后研究员Hugo Bisio和艾克斯-马赛大学同事的帮助下,Abergel使用了基于CRISPR/Cas9的基因编辑系统,修改了Acanthamoeba castellanii和感染它的巨型病毒Pandoravirus neocaledonia的基因组。
CRISPR/Cas9系统被设计用于删除特定基因,由两个引导RNA和一个Cas9分裂酶组成。与其他CRISPR/Cas9系统类似,每个引导RNA包含17到20个碱基,被设计成与巨型病毒或变形虫基因组上的一个特定位置结合,允许Cas9分裂酶在该位置切割基因组。
Acanthamoeba castellanii每条染色体包含25个副本,这使得设计一个可以删除每个基因副本的有效CRISPR/Cas9系统变得困难。为了克服这个问题,研究人员修改了他们的CRISPR/Cas9系统,以产生链式反应。每当DNA被切割以去除一个基因时,编码Cas9酶的DNA片段和负责切割的引导RNA将取代基因组中缺失的基因。这使得基因删除重复和传播,直到所有副本被删除。

图2 CRISPR/Cas9操作卡氏棘阿米巴(图源:[1])
复杂的病毒起源于更小更简单的病毒
一旦他们优化了CRISPR/Cas9系统,团队就从Pandoravirus基因组中分别删除了每个基因,并测量了由此产生的病毒生产变化,以确定每个基因对病毒生命周期的重要性。他们发现,必需基因聚集在基因组的一端,与非必需基因在另一端分离。比西奥说,在病毒中还没有发现过这种水平的基因有序性。即使是细菌基因组也不那么整齐:虽然它们确实将功能相连的基因分组成称为操纵子的基因簇,但这些基因簇往往分散在整个基因组中,而不是集中在一个点上。
必需基因簇可能与一种古老病毒的较小的“核心基因组”相呼应。这个基因组可能通过多轮偏向一个方向的基因复制而被拉长,以产生额外的一组多余的非必需基因。这可以解释现代巨型病毒是如何拥有数千个基因的。
作者指出“我们的数据表明,复杂病毒起源于更小、更简单的病毒,”需要进一步研究才能确定这是否适用于所有巨型病毒,还是仅仅适用于Pandoravirus。其他研究发现,巨型病毒中的一些基因是从它们的Acanthamoeba castellanii宿主那里篡夺的,这表明基因交换是巨型病毒增大体积的另一种方式。
研究小组随后将目光投向Pandoravirus的众多进化之谜之一:它没有衣壳。小病毒将它们的基因组包装成由病毒蛋白质构成的衣壳。虽然一些巨型病毒,如Mimivirus,延续了这一传统,但其他病毒,包括Pandoravirus病毒,却没有。如果巨型病毒确实是从较小的病毒进化而来,那么它们的基因组中可能隐藏着衣壳蛋白质的痕迹。因此,研究人员开始研究Pandoravirus病毒的近亲——较小的Mollivirus——潜在衣壳蛋白残余的功能,这种病毒也可以感染A. castellanii。

图3 潘多拉病毒基因组保留了其较小祖先的痕迹(图源:[1])
研究人员根据其基因序列和预测的3D形状,怀疑一种名为ml_347的Mollivirus蛋白质是从衣壳基因进化而来的。因此,该团队通过使用CRISPR/Cas9系统删除该基因来研究其功能。他们发现该基因对Mollivirus的组装很重要,作者说考虑到它可能的衣壳血统,这很有趣。有可能,随着衣壳在巨型病毒进化中丢失,过时的衣壳基因被适应了新的组装功能。
加州能源部联合基因组研究所的进化生物学家Frederik Schulz点评:看到CRISPR/Cas9技术被引入其他宿主物种(如藻类)将是令人兴奋的,这将允许研究人员将研究扩大到更多种类的巨型病毒。他还指出,该系统只适用于在宿主细胞核中复制的病毒,而大多数巨型病毒复制在被称为病毒工厂的细胞质结构中,Cas9酶和引导RNA无法穿透。
CRISPR/Cas9技术将用来梳理所有病毒基因的功能。
参考资料:
[1] Evolution of giant pandoravirus revealed by CRISPR/Cas9



