摘要:随着细胞工程技术的快速发展,CAR-T细胞免疫疗法在临床中除顽固肿瘤外均取得了持久的临床功效,表现出巨大的治疗潜力。
尽管CAR-T细胞疗法在血液瘤中已经多次取得较好疗效,但其在实体瘤治疗方面的临床试验结果仍然不够理想。
就实体瘤治疗而言,手术不彻底是治疗失败的主要风险因素,Carl June团队试图分析CAR-T细胞疗法是否可以作为辅助疗法来清除术后残留癌细胞,他们使用间皮素特异性CAR-T在两个部分切除异种移植模型中测试了这种方法的可行性。
对于胰腺导管腺癌(PDA)、三阴性乳腺癌(TNBC)这种治疗选择有限且预后不良的实体瘤,在通过手术切除原发肿瘤后,切缘处残留肿瘤细胞的风险仍旧很高,因此局部复发和较差临床结果的风险增加。对于这类患者,要是可以在手术中迅速清除肿瘤切除后残留的肿瘤细胞将会大有裨益。Carl June团队检验了这种假设,即局部、术中使用CAR-T细胞疗法可能是一种有效的辅助方法。
1月11日,CAR-T之父Carl June团队在Science Advances上发表了一篇名为“Chimeric antigen receptor T cells as adjuvant therapy for unresectable adenocarcinoma”的研究论文。研究人员发现,将含有CAR-T细胞的纤维蛋白凝胶应用于小鼠部分肿瘤切除后的手术伤口,结果表明CAR-T细胞显著清除了小鼠体内术后残留的肿瘤细胞,与未使用纤维蛋白凝胶治疗的小鼠相比,其总生存期显著延长。

图1 实验表明CAR-T细胞显著清除了小鼠体内术后残留的肿瘤细胞(图源:[1])
研究人员通过临床数据表明了直接肿瘤内注射CAR-T细胞的可行性,此外,他们发现在手术部位保留CAR-T细胞可以通过降低全身毒性以提高安全性。基于此,研究人员优化了组织粘合剂作为CAR-T细胞载体的使用,它可以在术中应用于伤口表面,并评估了纤维蛋白凝胶的使用。在该项研究中,研究人员使用用于CAR-T细胞接种的骨钻在头骨上制作了一个小窗口,然后使用纤维蛋白凝胶将其关闭。
为了开发出针对未完全切除的腺癌的治疗方法,研究人员建立了两种异种移植模型(PDA和TNBC)。首先,通过在异种移植模型中进行不同凝血酶浓度的体内滴定,发现CAR-T细胞的抗肿瘤功效取决于纤维蛋白凝胶剂量,当凝血酶浓度为3.0 U/ml时,可以更快更有效地清除残余肿瘤细胞。并且,还通过试验表明了纤维蛋白凝胶对治疗小鼠的肿瘤生长和总体存活率没有特异性影响。
在确定理想的纤维蛋白凝胶成分并排除其本身影响后,研究人员使用先前描述的人TNBC细胞系MDA-MB-231在异种移植模型中测试了这种方法的可行性。结果发现,不完全手术后的肿瘤再生仅发生在仅接受手术或手术后在纤维蛋白凝胶中直接腔内接种CAR19 T细胞的小鼠中,在术后直接腔内接种纤维蛋白凝胶中的CARM5 T细胞的小鼠中观察到肿瘤清除,且该类小鼠总生存期显著延长。
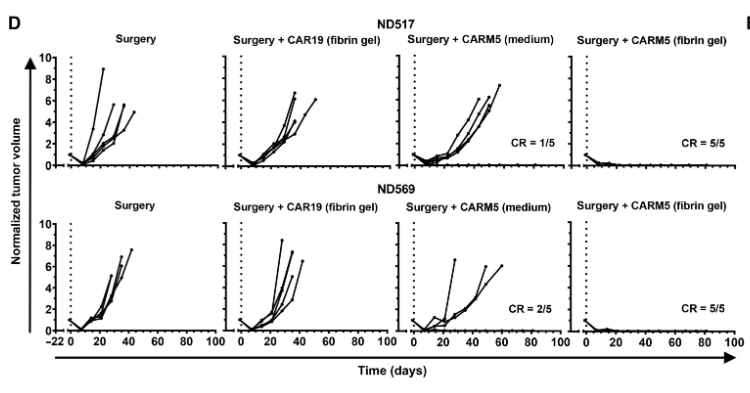
图2 纤维蛋白凝胶中的CAR-T细胞在TNBC异种移植模型中有效清除术后残留肿瘤细胞(图源:[1])
为了确认观察的肿瘤清除效果是否与肿瘤类型有关,研究人员再次在PDA模型中进行了试验,结果证实纤维蛋白凝胶中的CAR-T细胞在PDA异种移植模型中可清除术后残留细胞。
将两种异种移植模型的数据放在一起,该团队得出结论,即在纤维蛋白凝胶中局部递送CAR-T细胞可在手术后的较长时间内提供抗肿瘤活性。在植入纤维蛋白凝胶后,在一些小鼠体内检测到外周血中T细胞的系统性运输。
此外,对这种治疗方法的全身靶向脱瘤毒性进行评估,发现接受治疗的小鼠中只有很少甚至是没有T细胞浸润到肺部,同时没有一只小鼠表现出炎症或伤口愈合并发症的术后迹象,表明通过局部CAR-T细胞治疗可降低靶向脱瘤毒性。
以上研究表明,CAR-T细胞可以安全有效地用于清除两种动物模型中腺癌手术切除不完全后残留的癌细胞。并且,与通过全身给药的CAR-T细胞治疗的小鼠相比,靶向脱瘤毒性降低,在免疫功能低下或免疫功能正常的小鼠中未观察到伤口愈合并发症。
对此研究结果,Carl June博士表示:“随着继续推进CAR-T细胞疗法的研究,寻找如何将其用于实体瘤是一个主要目标。基于该项研究结果,我们计划在局部晚期乳腺癌患者中进行临床试验。”
该项研究证明了CAR-T细胞作为实体瘤手术附加疗法的潜力,研究人员还表示,除了CAR-T细胞之外,这种方法还可以扩展到其他细胞疗法和抗癌药物,从而有可能进一步提高抗肿瘤效果。
基于该项研究,研究团队计划对局部晚期乳腺癌患者进行临床试验。纤维蛋白凝胶已经获得FDA批准,并且人类间皮素特异性CAR-T细胞构建体现在正在不同的临床试验中进行系统给药后的测试,这些试验具有已知的毒性特征,进一步促进了该种治疗方法的临床转化。
总之,CAR-T细胞可以作为实体瘤切除手术后一种安全有效的辅助治疗方式,在这种情况下使用基于纤维蛋白胶的载体或许是一种有效工具,可以最大限度地提高CAR-T细胞在肿瘤切除部位的分布和抗肿瘤功效。期待这种实体瘤辅助治疗方法可以早日开展临床试验,进而惠及广大肿瘤患者。
参考资料:
[1] Uslu U, Da T, Assenmacher CA, et al. Chimeric antigen receptor T cells as adjuvant therapy for unresectable adenocarcinoma. Sci Adv. 2023 Jan 13;9(2):eade2526. doi: 10.1126/sciadv.ade2526. Epub 2023 Jan 11. PMID: 36630514; PMCID: PMC9833675.
摘要:随着细胞工程技术的快速发展,CAR-T细胞免疫疗法在临床中除顽固肿瘤外均取得了持久的临床功效,表现出巨大的治疗潜力。
尽管CAR-T细胞疗法在血液瘤中已经多次取得较好疗效,但其在实体瘤治疗方面的临床试验结果仍然不够理想。
就实体瘤治疗而言,手术不彻底是治疗失败的主要风险因素,Carl June团队试图分析CAR-T细胞疗法是否可以作为辅助疗法来清除术后残留癌细胞,他们使用间皮素特异性CAR-T在两个部分切除异种移植模型中测试了这种方法的可行性。
对于胰腺导管腺癌(PDA)、三阴性乳腺癌(TNBC)这种治疗选择有限且预后不良的实体瘤,在通过手术切除原发肿瘤后,切缘处残留肿瘤细胞的风险仍旧很高,因此局部复发和较差临床结果的风险增加。对于这类患者,要是可以在手术中迅速清除肿瘤切除后残留的肿瘤细胞将会大有裨益。Carl June团队检验了这种假设,即局部、术中使用CAR-T细胞疗法可能是一种有效的辅助方法。
1月11日,CAR-T之父Carl June团队在Science Advances上发表了一篇名为“Chimeric antigen receptor T cells as adjuvant therapy for unresectable adenocarcinoma”的研究论文。研究人员发现,将含有CAR-T细胞的纤维蛋白凝胶应用于小鼠部分肿瘤切除后的手术伤口,结果表明CAR-T细胞显著清除了小鼠体内术后残留的肿瘤细胞,与未使用纤维蛋白凝胶治疗的小鼠相比,其总生存期显著延长。

图1 实验表明CAR-T细胞显著清除了小鼠体内术后残留的肿瘤细胞(图源:[1])
研究人员通过临床数据表明了直接肿瘤内注射CAR-T细胞的可行性,此外,他们发现在手术部位保留CAR-T细胞可以通过降低全身毒性以提高安全性。基于此,研究人员优化了组织粘合剂作为CAR-T细胞载体的使用,它可以在术中应用于伤口表面,并评估了纤维蛋白凝胶的使用。在该项研究中,研究人员使用用于CAR-T细胞接种的骨钻在头骨上制作了一个小窗口,然后使用纤维蛋白凝胶将其关闭。
为了开发出针对未完全切除的腺癌的治疗方法,研究人员建立了两种异种移植模型(PDA和TNBC)。首先,通过在异种移植模型中进行不同凝血酶浓度的体内滴定,发现CAR-T细胞的抗肿瘤功效取决于纤维蛋白凝胶剂量,当凝血酶浓度为3.0 U/ml时,可以更快更有效地清除残余肿瘤细胞。并且,还通过试验表明了纤维蛋白凝胶对治疗小鼠的肿瘤生长和总体存活率没有特异性影响。
在确定理想的纤维蛋白凝胶成分并排除其本身影响后,研究人员使用先前描述的人TNBC细胞系MDA-MB-231在异种移植模型中测试了这种方法的可行性。结果发现,不完全手术后的肿瘤再生仅发生在仅接受手术或手术后在纤维蛋白凝胶中直接腔内接种CAR19 T细胞的小鼠中,在术后直接腔内接种纤维蛋白凝胶中的CARM5 T细胞的小鼠中观察到肿瘤清除,且该类小鼠总生存期显著延长。

图2 纤维蛋白凝胶中的CAR-T细胞在TNBC异种移植模型中有效清除术后残留肿瘤细胞(图源:[1])
为了确认观察的肿瘤清除效果是否与肿瘤类型有关,研究人员再次在PDA模型中进行了试验,结果证实纤维蛋白凝胶中的CAR-T细胞在PDA异种移植模型中可清除术后残留细胞。
将两种异种移植模型的数据放在一起,该团队得出结论,即在纤维蛋白凝胶中局部递送CAR-T细胞可在手术后的较长时间内提供抗肿瘤活性。在植入纤维蛋白凝胶后,在一些小鼠体内检测到外周血中T细胞的系统性运输。
此外,对这种治疗方法的全身靶向脱瘤毒性进行评估,发现接受治疗的小鼠中只有很少甚至是没有T细胞浸润到肺部,同时没有一只小鼠表现出炎症或伤口愈合并发症的术后迹象,表明通过局部CAR-T细胞治疗可降低靶向脱瘤毒性。
以上研究表明,CAR-T细胞可以安全有效地用于清除两种动物模型中腺癌手术切除不完全后残留的癌细胞。并且,与通过全身给药的CAR-T细胞治疗的小鼠相比,靶向脱瘤毒性降低,在免疫功能低下或免疫功能正常的小鼠中未观察到伤口愈合并发症。
对此研究结果,Carl June博士表示:“随着继续推进CAR-T细胞疗法的研究,寻找如何将其用于实体瘤是一个主要目标。基于该项研究结果,我们计划在局部晚期乳腺癌患者中进行临床试验。”
该项研究证明了CAR-T细胞作为实体瘤手术附加疗法的潜力,研究人员还表示,除了CAR-T细胞之外,这种方法还可以扩展到其他细胞疗法和抗癌药物,从而有可能进一步提高抗肿瘤效果。
基于该项研究,研究团队计划对局部晚期乳腺癌患者进行临床试验。纤维蛋白凝胶已经获得FDA批准,并且人类间皮素特异性CAR-T细胞构建体现在正在不同的临床试验中进行系统给药后的测试,这些试验具有已知的毒性特征,进一步促进了该种治疗方法的临床转化。
总之,CAR-T细胞可以作为实体瘤切除手术后一种安全有效的辅助治疗方式,在这种情况下使用基于纤维蛋白胶的载体或许是一种有效工具,可以最大限度地提高CAR-T细胞在肿瘤切除部位的分布和抗肿瘤功效。期待这种实体瘤辅助治疗方法可以早日开展临床试验,进而惠及广大肿瘤患者。
参考资料:
[1] Uslu U, Da T, Assenmacher CA, et al. Chimeric antigen receptor T cells as adjuvant therapy for unresectable adenocarcinoma. Sci Adv. 2023 Jan 13;9(2):eade2526. doi: 10.1126/sciadv.ade2526. Epub 2023 Jan 11. PMID: 36630514; PMCID: PMC9833675.



