摘要:哥伦比亚大学的研究人员发明了一种多模态测序技术,可以从小体积的冷冻肿瘤标本中获得高质量的结果——研究生物库中存档的癌症组织的能力应该会增加用于科学分析的肿瘤样本的数量和种类,并促进生物标志物和药物靶点的发现。
研究人员发明了一种新的RNA测序方法,可以从小体积的冷冻肿瘤标本中获得高质量的结果。他们在两项临床研究中证明了他们技术的成功,这些临床研究分析了数十个肿瘤样本,包括存档的和新收集的,以了解它们对抗肿瘤治疗的反应。

图1 研究人员发明了一种新的RNA测序方法,可以从小体积的冷冻肿瘤标本中获得高质量的结果(图源:[1])
在过去十年中,使用RNA测序来测量单细胞分辨率下的基因表达是研究癌症组织最具变革性的工具之一。通过检查单个细胞的RNA,研究人员可以更好地了解肿瘤内细胞的多样性,以及这些肿瘤细胞如何生长以及如何与免疫细胞相互作用。这些都是理解癌症进展的特征和癌症对治疗的耐药性的重要因素,两者都是开发新的癌症治疗方法的关键。
重大的挑战
在传统的临床工作流程中广泛采用单细胞RNA测序的一个主要障碍是,所需的新鲜组织的数量远远超过临床目的常规收集的数量。对新鲜组织的需求意味着样本采集后必须立即进行分析。这些要求极大地限制了对患者样本进行的科学分析。
新技术
为了克服这些障碍,哥伦比亚大学的研究小组创造了一种新的测序方法,从少量冷冻肿瘤标本中获得了最佳结果。这些标本通常在临床试验期间收集并储存在生物库中,可能包括来自罕见癌症和具有独特病史或危险因素的患者的组织。这项新技术对这些类型的标本进行测序的能力大大增加了可用于科学分析的肿瘤样本的数量和种类。
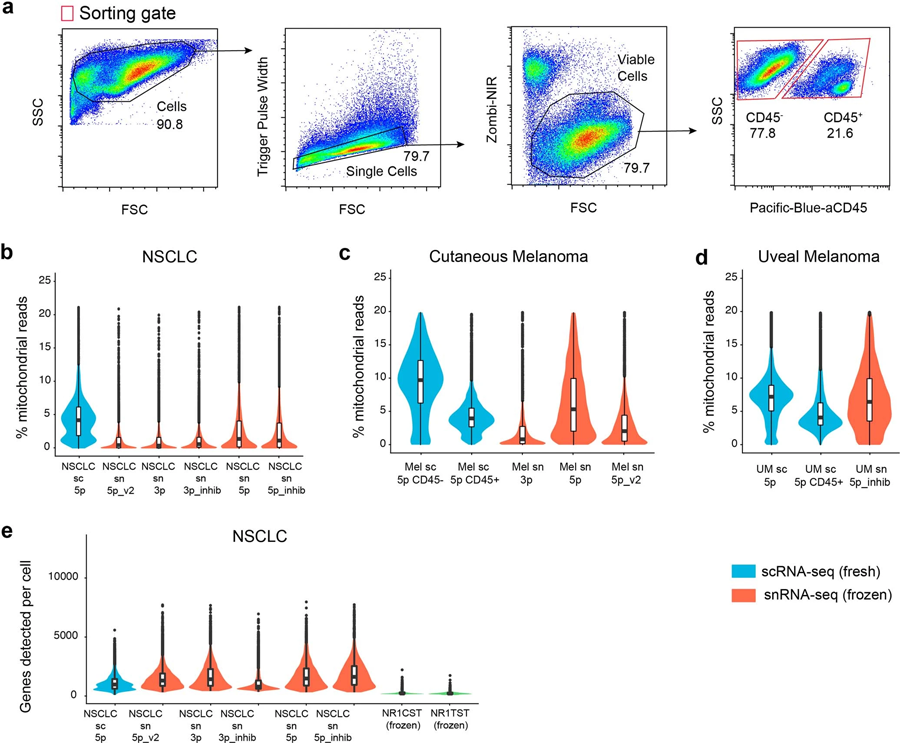
图2 新鲜和冷冻样本的设门方法和其他测序质量指标(图源:[1])
“我们对这项工作及其潜力感到非常兴奋,”生物医学工程助理教授Elham Azizi说。
“从冷冻样本中工作的能力为多机构合作打开了大门,这将推动生物标志物和药物靶点的发现。它还使我们有机会将尖端计算技术应用于分析和整合未解锁的临床数据,”Azizi解释说。
“由于我们的方法只需要少量的组织,剩余的样本可以用于其他研究。这对研究人员和临床医生,最重要的是,对我们的患者来说是双赢的。”
研究结果扩大了对癌症进展的理解
这项新研究从单细胞RNA测序、单细胞t细胞受体测序、全基因组测序和空间RNA测序(一种保留肿瘤结构的创新RNA测序方法)中获得结果,这些都是在相同的样本上进行的。通过连接癌症数据的多种模式,研究人员提供了遗传改变、细胞功能、免疫细胞动力学和细胞在患者组织环境中的空间定位的全面视图。这些改进极大地拓宽了他们对癌症进展和耐药机制的理解。
下一个步骤
该团队目前正在应用他们新颖的实验和计算技术来分析更大的临床队列。这些数据使他们能够更好地研究疾病进展,并检查在黑色素瘤和其他癌症类型的临床试验中治疗方法的影响。
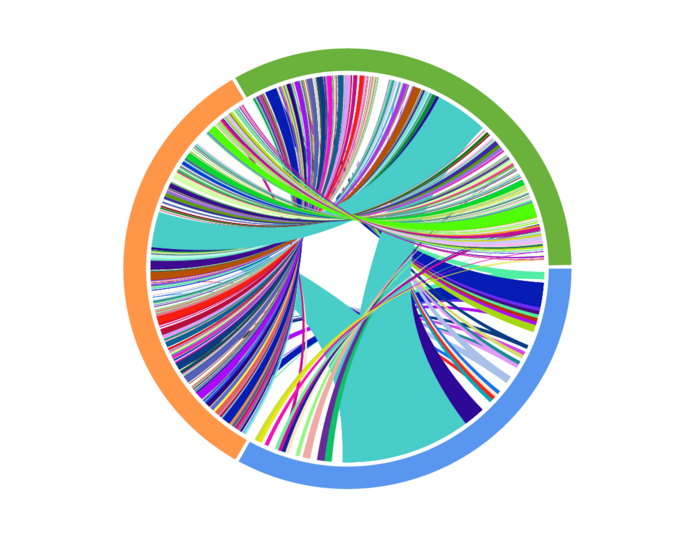
图3 在接受抗pd1治疗的患者身上收集的匹配T细胞受体测序结果的Circos图。颜色表示收集时间(蓝色:治疗前,橙色:治疗中,绿色:治疗后),连接表示相同TCRs的重叠。这些结果表明,随着时间的推移,T细胞克隆型显著多样化。
ECHIDNA,一种新的计算工具
与此同时,研究人员还在开发一种创新的计算工具,用于全基因组数据和单细胞RNA测序的系统整合分析,名为ECHIDNA。他们希望这种机器学习算法能够成为理解肿瘤细胞中基因改变(基因型)和细胞功能(表型)之间关系的关键,并将其应用于更大的黑色素瘤患者群体,以表征治疗耐药性的各种机制。未来的工作还将包括建立新的计算方法,在组织学切片的空间背景下集成这些数据,以表征肿瘤-免疫细胞相互作用的空间动态。
Izar指出:“除了了解癌症组织,我们的方法还可以研究其他疾病的组织反应和组织免疫学。在过去,我们使用了本文提出的方法的早期版本来研究跨多个器官对致命COVID-19感染的组织反应。这证明了癌症研究发展的一个例子,可以推动整个生命科学研究。”
参考资料:
[1] Multi-modal single-cell and whole-genome sequencing of small, frozen clinical specimens
摘要:哥伦比亚大学的研究人员发明了一种多模态测序技术,可以从小体积的冷冻肿瘤标本中获得高质量的结果——研究生物库中存档的癌症组织的能力应该会增加用于科学分析的肿瘤样本的数量和种类,并促进生物标志物和药物靶点的发现。
研究人员发明了一种新的RNA测序方法,可以从小体积的冷冻肿瘤标本中获得高质量的结果。他们在两项临床研究中证明了他们技术的成功,这些临床研究分析了数十个肿瘤样本,包括存档的和新收集的,以了解它们对抗肿瘤治疗的反应。

图1 研究人员发明了一种新的RNA测序方法,可以从小体积的冷冻肿瘤标本中获得高质量的结果(图源:[1])
在过去十年中,使用RNA测序来测量单细胞分辨率下的基因表达是研究癌症组织最具变革性的工具之一。通过检查单个细胞的RNA,研究人员可以更好地了解肿瘤内细胞的多样性,以及这些肿瘤细胞如何生长以及如何与免疫细胞相互作用。这些都是理解癌症进展的特征和癌症对治疗的耐药性的重要因素,两者都是开发新的癌症治疗方法的关键。
重大的挑战
在传统的临床工作流程中广泛采用单细胞RNA测序的一个主要障碍是,所需的新鲜组织的数量远远超过临床目的常规收集的数量。对新鲜组织的需求意味着样本采集后必须立即进行分析。这些要求极大地限制了对患者样本进行的科学分析。
新技术
为了克服这些障碍,哥伦比亚大学的研究小组创造了一种新的测序方法,从少量冷冻肿瘤标本中获得了最佳结果。这些标本通常在临床试验期间收集并储存在生物库中,可能包括来自罕见癌症和具有独特病史或危险因素的患者的组织。这项新技术对这些类型的标本进行测序的能力大大增加了可用于科学分析的肿瘤样本的数量和种类。

图2 新鲜和冷冻样本的设门方法和其他测序质量指标(图源:[1])
“我们对这项工作及其潜力感到非常兴奋,”生物医学工程助理教授Elham Azizi说。
“从冷冻样本中工作的能力为多机构合作打开了大门,这将推动生物标志物和药物靶点的发现。它还使我们有机会将尖端计算技术应用于分析和整合未解锁的临床数据,”Azizi解释说。
“由于我们的方法只需要少量的组织,剩余的样本可以用于其他研究。这对研究人员和临床医生,最重要的是,对我们的患者来说是双赢的。”
研究结果扩大了对癌症进展的理解
这项新研究从单细胞RNA测序、单细胞t细胞受体测序、全基因组测序和空间RNA测序(一种保留肿瘤结构的创新RNA测序方法)中获得结果,这些都是在相同的样本上进行的。通过连接癌症数据的多种模式,研究人员提供了遗传改变、细胞功能、免疫细胞动力学和细胞在患者组织环境中的空间定位的全面视图。这些改进极大地拓宽了他们对癌症进展和耐药机制的理解。
下一个步骤
该团队目前正在应用他们新颖的实验和计算技术来分析更大的临床队列。这些数据使他们能够更好地研究疾病进展,并检查在黑色素瘤和其他癌症类型的临床试验中治疗方法的影响。

图3 在接受抗pd1治疗的患者身上收集的匹配T细胞受体测序结果的Circos图。颜色表示收集时间(蓝色:治疗前,橙色:治疗中,绿色:治疗后),连接表示相同TCRs的重叠。这些结果表明,随着时间的推移,T细胞克隆型显著多样化。
ECHIDNA,一种新的计算工具
与此同时,研究人员还在开发一种创新的计算工具,用于全基因组数据和单细胞RNA测序的系统整合分析,名为ECHIDNA。他们希望这种机器学习算法能够成为理解肿瘤细胞中基因改变(基因型)和细胞功能(表型)之间关系的关键,并将其应用于更大的黑色素瘤患者群体,以表征治疗耐药性的各种机制。未来的工作还将包括建立新的计算方法,在组织学切片的空间背景下集成这些数据,以表征肿瘤-免疫细胞相互作用的空间动态。
Izar指出:“除了了解癌症组织,我们的方法还可以研究其他疾病的组织反应和组织免疫学。在过去,我们使用了本文提出的方法的早期版本来研究跨多个器官对致命COVID-19感染的组织反应。这证明了癌症研究发展的一个例子,可以推动整个生命科学研究。”
参考资料:
[1] Multi-modal single-cell and whole-genome sequencing of small, frozen clinical specimens



