摘要:MedUni维也纳研究团队发现了一种用于CAR-T细胞治疗临床反应的高效生物标志物,描述了优化使用这种新型疗法治疗淋巴瘤的先决条件。目前的发现是朝着优化这种有前景的治疗方法迈出的重要一步。这项研究的结果最近发表在顶级杂志《Frontiers in Immunology》上。
MedUni维也纳研究团队发现了一种用于CAR-T细胞治疗临床反应的高效生物标志物,描述了优化使用这种新型疗法治疗淋巴瘤的先决条件。目前的发现是朝着优化这种有前景的治疗方法迈出的重要一步。这项研究的结果最近发表在顶级杂志《Frontiers in Immunology》上。

图1 研究团队发现了一种用于CAR-T细胞治疗临床反应的高效生物标志物(图源:[1])
弥漫性大B细胞淋巴瘤(DLBCL)是淋巴瘤(非霍奇金淋巴瘤)最常见的形式。现在5年存活率在55%到64%之间。然而,早期复发或对联合抗体化疗无反应的患者预后更差。
近年来,一种新的、非常有效的治疗方式出现了:CAR-T细胞。在这种疗法中,人体自身的淋巴细胞被提取,并配备了淋巴癌细胞特异性的嵌合T细胞受体(CAR =嵌合抗原受体),扩增后返回患者体内。由于嵌合T细胞受体的表达,T细胞被转化为杀伤细胞,在最好的情况下,永远消除患者体内的淋巴癌细胞。尽管这种疗法在CAR-T细胞对淋巴瘤细胞有反应时非常有效并能使患者长期存活;不幸的是,它并不是对所有患者都有效。
在他们的临床研究中,科学家们从CAR-T细胞产生的起点开始:患者自身T淋巴细胞(T细胞)的性质。在这个过程中,他们发现淋巴瘤患者通常缺乏T淋巴细胞(T细胞淋巴细胞减少症)。由于淋巴细胞减少通常伴随着“耗尽”T细胞的增加,本研究开始测量这些细胞的数量。事实上,在一部分患者中,精疲力尽的T细胞显著增加。这种耗尽的T细胞通常只在患有慢性炎症的患者中发现。
根据这些观察,由Nina Worel(输血医学)和Ulrich Jäger(血液学)领导的研究团队与Winfried Pickl的团队(免疫学研究所)合作,创建了将患者分为对CAR-T细胞治疗反应概率高和低的患者组的基础。
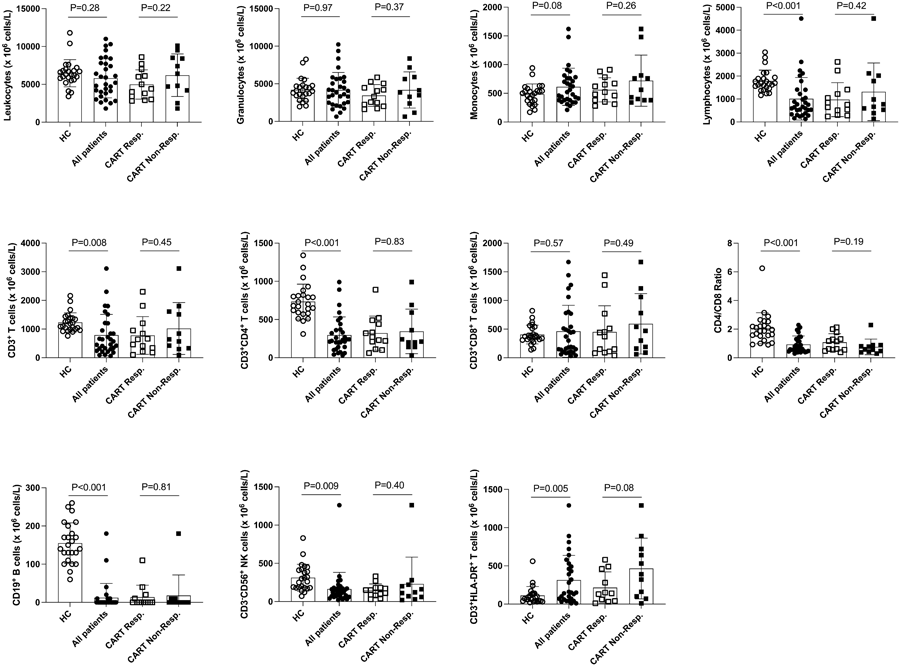
图2 健康对照者、弥漫性大B细胞淋巴瘤患者和CART细胞治疗接受者的PB中白细胞群的分布(图源:[1])
研究负责人Winfried Pickl说:“我们的研究表明,T细胞的性质对CAR-T细胞的产生有多么重要,在相当一部分患者中可以发现,耗尽的T细胞对后续的CAR-T细胞治疗构成了一个问题。我们对被用作CAR-T细胞生产起始材料的不同耗尽T细胞的作用模式的观察表明,分化程度对CAR-T细胞直接杀死癌细胞没有负面影响,但它确实对白血病细胞依赖的生长和CAR-T细胞的因子生产有负面影响。这表明耗尽的CD27negCD28neg-CAR-T细胞可能无法在患者体内存活更长的时间,这可能会限制它们的长期疗效。”
总而言之,Pickl指出:“白细胞分离时CD3posCD27negCD28neg-T细胞的低分化(耗尽)代表了一种新的血液生物标志物,甚至可以在CAR-T细胞开始生产和输注之前使用,并预测患者对CAR-T细胞治疗的反应。在CAR-T细胞生产开始之前从白细胞分离产品中去除这种细胞可以显著提高治疗的成功率,即使在初始情况不佳的患者中也是如此。”
参考资料:
[1] The frequency of differentiated CD3+CD27-CD28- T cells predicts response to CART cell therapy in diffuse large B-cell lymphoma
摘要:MedUni维也纳研究团队发现了一种用于CAR-T细胞治疗临床反应的高效生物标志物,描述了优化使用这种新型疗法治疗淋巴瘤的先决条件。目前的发现是朝着优化这种有前景的治疗方法迈出的重要一步。这项研究的结果最近发表在顶级杂志《Frontiers in Immunology》上。
MedUni维也纳研究团队发现了一种用于CAR-T细胞治疗临床反应的高效生物标志物,描述了优化使用这种新型疗法治疗淋巴瘤的先决条件。目前的发现是朝着优化这种有前景的治疗方法迈出的重要一步。这项研究的结果最近发表在顶级杂志《Frontiers in Immunology》上。

图1 研究团队发现了一种用于CAR-T细胞治疗临床反应的高效生物标志物(图源:[1])
弥漫性大B细胞淋巴瘤(DLBCL)是淋巴瘤(非霍奇金淋巴瘤)最常见的形式。现在5年存活率在55%到64%之间。然而,早期复发或对联合抗体化疗无反应的患者预后更差。
近年来,一种新的、非常有效的治疗方式出现了:CAR-T细胞。在这种疗法中,人体自身的淋巴细胞被提取,并配备了淋巴癌细胞特异性的嵌合T细胞受体(CAR =嵌合抗原受体),扩增后返回患者体内。由于嵌合T细胞受体的表达,T细胞被转化为杀伤细胞,在最好的情况下,永远消除患者体内的淋巴癌细胞。尽管这种疗法在CAR-T细胞对淋巴瘤细胞有反应时非常有效并能使患者长期存活;不幸的是,它并不是对所有患者都有效。
在他们的临床研究中,科学家们从CAR-T细胞产生的起点开始:患者自身T淋巴细胞(T细胞)的性质。在这个过程中,他们发现淋巴瘤患者通常缺乏T淋巴细胞(T细胞淋巴细胞减少症)。由于淋巴细胞减少通常伴随着“耗尽”T细胞的增加,本研究开始测量这些细胞的数量。事实上,在一部分患者中,精疲力尽的T细胞显著增加。这种耗尽的T细胞通常只在患有慢性炎症的患者中发现。
根据这些观察,由Nina Worel(输血医学)和Ulrich Jäger(血液学)领导的研究团队与Winfried Pickl的团队(免疫学研究所)合作,创建了将患者分为对CAR-T细胞治疗反应概率高和低的患者组的基础。

图2 健康对照者、弥漫性大B细胞淋巴瘤患者和CART细胞治疗接受者的PB中白细胞群的分布(图源:[1])
研究负责人Winfried Pickl说:“我们的研究表明,T细胞的性质对CAR-T细胞的产生有多么重要,在相当一部分患者中可以发现,耗尽的T细胞对后续的CAR-T细胞治疗构成了一个问题。我们对被用作CAR-T细胞生产起始材料的不同耗尽T细胞的作用模式的观察表明,分化程度对CAR-T细胞直接杀死癌细胞没有负面影响,但它确实对白血病细胞依赖的生长和CAR-T细胞的因子生产有负面影响。这表明耗尽的CD27negCD28neg-CAR-T细胞可能无法在患者体内存活更长的时间,这可能会限制它们的长期疗效。”
总而言之,Pickl指出:“白细胞分离时CD3posCD27negCD28neg-T细胞的低分化(耗尽)代表了一种新的血液生物标志物,甚至可以在CAR-T细胞开始生产和输注之前使用,并预测患者对CAR-T细胞治疗的反应。在CAR-T细胞生产开始之前从白细胞分离产品中去除这种细胞可以显著提高治疗的成功率,即使在初始情况不佳的患者中也是如此。”
参考资料:
[1] The frequency of differentiated CD3+CD27-CD28- T cells predicts response to CART cell therapy in diffuse large B-cell lymphoma



