摘要:一项新的研究发现,SARS-CoV-2刺突蛋白会导致血管泄漏,这是一种从血管中释放液体的危险行为,可导致呼吸衰竭。
发表在《Nature Communications》杂志上的一项新研究揭示了SARS-CoV-2病毒产生的病毒毒素可能会导致严重的COVID-19感染。
这项研究显示了部分SARS-CoV-2“刺突”蛋白如何破坏身体器官(如肺部)血管内部的细胞屏障,导致所谓的血管泄漏。阻断这种蛋白质的活性可能有助于预防COVID-19的一些致命症状,包括肺水肿,肺水肿会导致急性呼吸窘迫综合征(ARDS)。

图1 SARS-CoV-2病毒产生的病毒毒素可能会导致严重的COVID-19感染
“从理论上讲,通过专门针对这一途径,我们可以阻断导致血管疾病和急性呼吸窘迫综合征的发病机制,而不需要针对病毒本身,”该研究的主要作者、加州大学伯克利分校的博士后学者Scott B. Biering说。“鉴于所有正在出现的不同变体,以及单独预防每种变体的感染的困难,除了完全阻止感染之外,关注这些致病的触发因素可能是有益的。”
虽然许多疫苗怀疑人士对SARS-CoV-2刺突蛋白(COVID-19 mRNA疫苗的靶标)的潜在危险表示担忧,但研究人员表示,他们的工作没有提供证据表明,在没有病毒感染的情况下,刺突蛋白会引起症状。相反,他们的研究表明,刺突蛋白可能与病毒和身体自身的免疫反应协同作用,引发危及生命的症状。
此外,接种疫苗后体内循环的刺突蛋白的浓度远低于在严重COVID-19患者中观察到的浓度和研究中使用的浓度。
该研究的资深作者、加州大学伯克利分校的传染病和疫苗学教授Eva Harris说:“疫苗中含有的刺突蛋白的数量永远不会导致泄漏。此外,没有证据表明(刺突蛋白)本身具有致病性。我们的想法是,它能够帮助和教唆持续的感染。”
通过研究SARS-CoV-2刺突蛋白对人类肺部和血管细胞以及小鼠肺部的影响,研究小组发现了允许刺突蛋白破坏体内关键屏障的分子途径。除了为治疗严重的COVID-19开辟新的途径外,了解刺突蛋白是如何导致血管渗漏的,还可以揭示其他新兴传染病背后的病理学。
Biering说:“我们认为,许多导致严重疾病的病毒可能会编码一种病毒毒素。这些蛋白质不受病毒感染,与屏障细胞相互作用,导致这些屏障失灵。这使得病毒得以传播,病毒的放大和血管泄漏是引发严重疾病的原因。我希望我们可以利用我们从SARS-CoV-2病毒中学到的原理,找到阻断这种发病机制的方法,以便在下一次大流行发生时做好更充分的准备。”
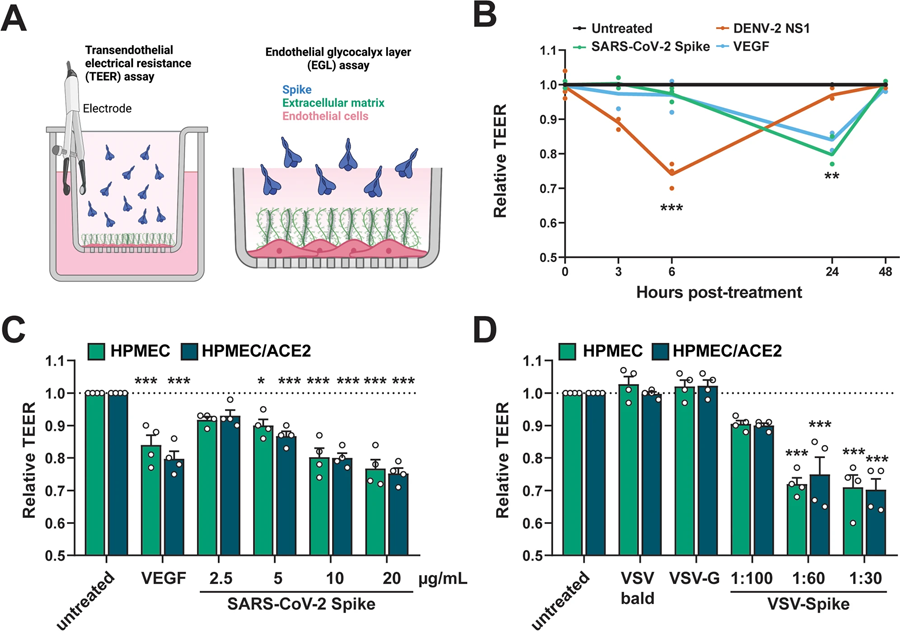
图2 SARS-CoV-2 S触发内皮和上皮渗透性屏障(图源:[1])
刺突蛋白如何引发血管渗漏
当排列在血管和毛细血管上的细胞被破坏,导致血浆和其他液体从血液中泄漏时,就会发生血管渗漏。除了在重症COVID-19中观察到的肺和心脏损伤外,血管渗漏还可导致低血容量性休克,这是登革热死亡的主要原因。
在COVID-19大流行之前,Biering和Harris研究项目的其他成员正在研究登革热病毒蛋白NS1在触发血管渗漏和导致低血容量性休克中的作用。当大流行爆发时,该团队想知道SARS-CoV-2中类似的病毒毒素是否也可能导致导致COVID-19患者死亡的急性呼吸窘迫综合征。
Harris说:“人们已经意识到细菌毒素的作用,但病毒毒素的概念仍然是一个真正的新概念。”“我们已经确定了这种从登革病毒感染的细胞中分泌的蛋白质,即使在没有病毒的情况下,也能够引起内皮细胞的通透性并破坏内部屏障。所以,我们想知道SARS-CoV-2蛋白质,如spike,是否能够做类似的事情。”
刺突蛋白覆盖在SARS-CoV-2的外表面,使病毒具有多节的外观。它们在帮助病毒感染宿主方面发挥着关键作用:刺突蛋白与人类和其他哺乳动物细胞上的一种名为ACE2的受体结合,就像钥匙转动锁一样,允许病毒进入细胞并劫持细胞功能。SARS-CoV-2病毒感染细胞时,会脱落大量含有受体结合结构域(RBD)的刺突蛋白。
Biering说:“真正有趣的是,循环刺突蛋白与临床中严重的COVID-19病例相关。我们想知道这种蛋白质是否也导致了我们在SARS-CoV-2中看到的任何血管泄漏。”
目前,科学家将与严重的COVID-19相关的心肺损伤归因于一种被称为细胞因子风暴的过度活跃的免疫反应。为了验证刺突蛋白可能也起作用的理论,Biering和其他团队成员使用薄层的人体内皮细胞和上皮细胞来模拟体内血管的内衬。他们发现,将这些细胞层暴露在刺突蛋白下增加了它们的渗透性,这是血管渗漏的标志。
利用CRISPR-Cas9基因编辑技术,研究小组表明,即使在不表达ACE2受体的细胞中,渗透性也会增加,这表明它可以独立于病毒感染而发生。此外,他们发现暴露于刺突蛋白的小鼠也表现出血管渗漏,尽管小鼠不表达人类ACE2受体,也不会感染SARS-CoV-2。
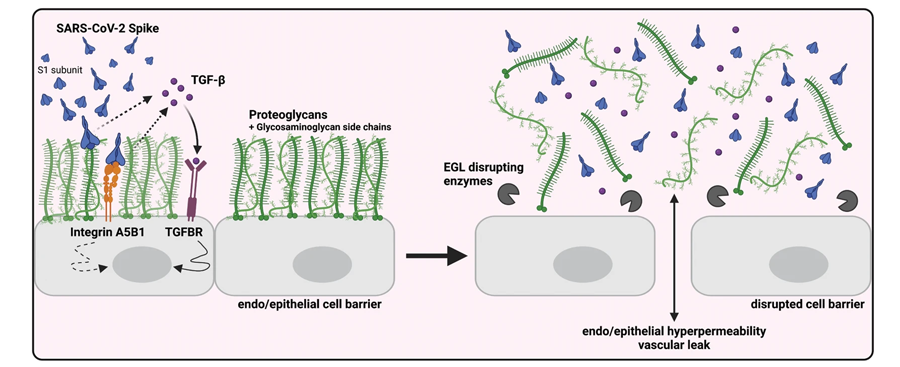
图3 SARS-CoV-2 S触发TGF-β的产生,TGF-β信号传导是S介导的屏障功能障碍所必需的(图源:[1])
最后,在RNA测序的帮助下,研究人员发现刺突蛋白通过一个涉及聚糖、整合素和转化生长因子β (TGF- β)的分子信号通路触发血管泄漏。通过阻断整合素的活性,该团队能够逆转小鼠的血管泄漏。
“我们发现了SARS-CoV-2的一种新的致病机制,其中刺突蛋白可以打破我们血管系统的屏障。由此导致的通透性增加会导致血管渗漏,就像在严重的COVID-19病例中经常观察到的那样,我们可以在我们的小鼠模型中重现这些疾病的表现,”研究合著者、加州大学伯克利分校公共卫生学院Harris实验室的研究生Felix Pahmeier说。“看到刺突病毒蛋白和登革病毒蛋白NS1之间的异同是很有趣的。两者都能破坏内皮屏障,但两者之间的时间线和宿主途径似乎不同。”
虽然阻断整合素的活性可能是治疗严重COVID-19的一个有希望的靶点,但Harris说,需要做更多的工作来了解这一途径在疾病进展中的确切作用。虽然血管通透性增加会加速感染并导致内出血,但它也可以通过让免疫机制更好地接近被感染的细胞来帮助身体对抗病毒。
“SARS-CoV-2进化出一种刺突表面蛋白,通过获得RGD motif,与宿主细胞膜因子(如整合素)相互作用的能力增强。该motif是一种常见的整合素结合因子,被许多病原体利用,包括细菌和其他病毒,来感染宿主细胞,”Harris实验室的前助理项目科学家、该研究的共同第一作者Francielle Tramontini Gomes de Sousa说。“我们的研究显示了峰值RGD如何与整合素相互作用,导致TGF- β释放和TGF- β信号的激活。利用上皮细胞、内皮细胞和血管通透性的体外和体内模型,我们能够更好地了解COVID-19患者TGF- β水平升高的细胞机制,以及spike-宿主细胞相互作用如何导致疾病。”
该团队正在继续研究导致血管泄漏的分子机制,并正在研究其他导致人类严重疾病的病毒中可能的病毒毒素。
“COVID-19没有消失。我们现在有更好的疫苗,但我们不知道病毒未来会如何变异。研究这一过程可能有助于我们开发一种新的药物库,这样如果有人经历血管泄漏,我们就可以针对它。也许它不能阻止病毒复制,但它可以阻止那个人死亡。”
参考资料:
[1] SARS-CoV-2 Spike triggers barrier dysfunction and vascular leak via integrins and TGF-β signaling. Nature Communications, 2022; 13 (1) DOI: 10.1038/s41467-022-34910-5
摘要:一项新的研究发现,SARS-CoV-2刺突蛋白会导致血管泄漏,这是一种从血管中释放液体的危险行为,可导致呼吸衰竭。
发表在《Nature Communications》杂志上的一项新研究揭示了SARS-CoV-2病毒产生的病毒毒素可能会导致严重的COVID-19感染。
这项研究显示了部分SARS-CoV-2“刺突”蛋白如何破坏身体器官(如肺部)血管内部的细胞屏障,导致所谓的血管泄漏。阻断这种蛋白质的活性可能有助于预防COVID-19的一些致命症状,包括肺水肿,肺水肿会导致急性呼吸窘迫综合征(ARDS)。

图1 SARS-CoV-2病毒产生的病毒毒素可能会导致严重的COVID-19感染
“从理论上讲,通过专门针对这一途径,我们可以阻断导致血管疾病和急性呼吸窘迫综合征的发病机制,而不需要针对病毒本身,”该研究的主要作者、加州大学伯克利分校的博士后学者Scott B. Biering说。“鉴于所有正在出现的不同变体,以及单独预防每种变体的感染的困难,除了完全阻止感染之外,关注这些致病的触发因素可能是有益的。”
虽然许多疫苗怀疑人士对SARS-CoV-2刺突蛋白(COVID-19 mRNA疫苗的靶标)的潜在危险表示担忧,但研究人员表示,他们的工作没有提供证据表明,在没有病毒感染的情况下,刺突蛋白会引起症状。相反,他们的研究表明,刺突蛋白可能与病毒和身体自身的免疫反应协同作用,引发危及生命的症状。
此外,接种疫苗后体内循环的刺突蛋白的浓度远低于在严重COVID-19患者中观察到的浓度和研究中使用的浓度。
该研究的资深作者、加州大学伯克利分校的传染病和疫苗学教授Eva Harris说:“疫苗中含有的刺突蛋白的数量永远不会导致泄漏。此外,没有证据表明(刺突蛋白)本身具有致病性。我们的想法是,它能够帮助和教唆持续的感染。”
通过研究SARS-CoV-2刺突蛋白对人类肺部和血管细胞以及小鼠肺部的影响,研究小组发现了允许刺突蛋白破坏体内关键屏障的分子途径。除了为治疗严重的COVID-19开辟新的途径外,了解刺突蛋白是如何导致血管渗漏的,还可以揭示其他新兴传染病背后的病理学。
Biering说:“我们认为,许多导致严重疾病的病毒可能会编码一种病毒毒素。这些蛋白质不受病毒感染,与屏障细胞相互作用,导致这些屏障失灵。这使得病毒得以传播,病毒的放大和血管泄漏是引发严重疾病的原因。我希望我们可以利用我们从SARS-CoV-2病毒中学到的原理,找到阻断这种发病机制的方法,以便在下一次大流行发生时做好更充分的准备。”

图2 SARS-CoV-2 S触发内皮和上皮渗透性屏障(图源:[1])
刺突蛋白如何引发血管渗漏
当排列在血管和毛细血管上的细胞被破坏,导致血浆和其他液体从血液中泄漏时,就会发生血管渗漏。除了在重症COVID-19中观察到的肺和心脏损伤外,血管渗漏还可导致低血容量性休克,这是登革热死亡的主要原因。
在COVID-19大流行之前,Biering和Harris研究项目的其他成员正在研究登革热病毒蛋白NS1在触发血管渗漏和导致低血容量性休克中的作用。当大流行爆发时,该团队想知道SARS-CoV-2中类似的病毒毒素是否也可能导致导致COVID-19患者死亡的急性呼吸窘迫综合征。
Harris说:“人们已经意识到细菌毒素的作用,但病毒毒素的概念仍然是一个真正的新概念。”“我们已经确定了这种从登革病毒感染的细胞中分泌的蛋白质,即使在没有病毒的情况下,也能够引起内皮细胞的通透性并破坏内部屏障。所以,我们想知道SARS-CoV-2蛋白质,如spike,是否能够做类似的事情。”
刺突蛋白覆盖在SARS-CoV-2的外表面,使病毒具有多节的外观。它们在帮助病毒感染宿主方面发挥着关键作用:刺突蛋白与人类和其他哺乳动物细胞上的一种名为ACE2的受体结合,就像钥匙转动锁一样,允许病毒进入细胞并劫持细胞功能。SARS-CoV-2病毒感染细胞时,会脱落大量含有受体结合结构域(RBD)的刺突蛋白。
Biering说:“真正有趣的是,循环刺突蛋白与临床中严重的COVID-19病例相关。我们想知道这种蛋白质是否也导致了我们在SARS-CoV-2中看到的任何血管泄漏。”
目前,科学家将与严重的COVID-19相关的心肺损伤归因于一种被称为细胞因子风暴的过度活跃的免疫反应。为了验证刺突蛋白可能也起作用的理论,Biering和其他团队成员使用薄层的人体内皮细胞和上皮细胞来模拟体内血管的内衬。他们发现,将这些细胞层暴露在刺突蛋白下增加了它们的渗透性,这是血管渗漏的标志。
利用CRISPR-Cas9基因编辑技术,研究小组表明,即使在不表达ACE2受体的细胞中,渗透性也会增加,这表明它可以独立于病毒感染而发生。此外,他们发现暴露于刺突蛋白的小鼠也表现出血管渗漏,尽管小鼠不表达人类ACE2受体,也不会感染SARS-CoV-2。

图3 SARS-CoV-2 S触发TGF-β的产生,TGF-β信号传导是S介导的屏障功能障碍所必需的(图源:[1])
最后,在RNA测序的帮助下,研究人员发现刺突蛋白通过一个涉及聚糖、整合素和转化生长因子β (TGF- β)的分子信号通路触发血管泄漏。通过阻断整合素的活性,该团队能够逆转小鼠的血管泄漏。
“我们发现了SARS-CoV-2的一种新的致病机制,其中刺突蛋白可以打破我们血管系统的屏障。由此导致的通透性增加会导致血管渗漏,就像在严重的COVID-19病例中经常观察到的那样,我们可以在我们的小鼠模型中重现这些疾病的表现,”研究合著者、加州大学伯克利分校公共卫生学院Harris实验室的研究生Felix Pahmeier说。“看到刺突病毒蛋白和登革病毒蛋白NS1之间的异同是很有趣的。两者都能破坏内皮屏障,但两者之间的时间线和宿主途径似乎不同。”
虽然阻断整合素的活性可能是治疗严重COVID-19的一个有希望的靶点,但Harris说,需要做更多的工作来了解这一途径在疾病进展中的确切作用。虽然血管通透性增加会加速感染并导致内出血,但它也可以通过让免疫机制更好地接近被感染的细胞来帮助身体对抗病毒。
“SARS-CoV-2进化出一种刺突表面蛋白,通过获得RGD motif,与宿主细胞膜因子(如整合素)相互作用的能力增强。该motif是一种常见的整合素结合因子,被许多病原体利用,包括细菌和其他病毒,来感染宿主细胞,”Harris实验室的前助理项目科学家、该研究的共同第一作者Francielle Tramontini Gomes de Sousa说。“我们的研究显示了峰值RGD如何与整合素相互作用,导致TGF- β释放和TGF- β信号的激活。利用上皮细胞、内皮细胞和血管通透性的体外和体内模型,我们能够更好地了解COVID-19患者TGF- β水平升高的细胞机制,以及spike-宿主细胞相互作用如何导致疾病。”
该团队正在继续研究导致血管泄漏的分子机制,并正在研究其他导致人类严重疾病的病毒中可能的病毒毒素。
“COVID-19没有消失。我们现在有更好的疫苗,但我们不知道病毒未来会如何变异。研究这一过程可能有助于我们开发一种新的药物库,这样如果有人经历血管泄漏,我们就可以针对它。也许它不能阻止病毒复制,但它可以阻止那个人死亡。”
参考资料:
[1] SARS-CoV-2 Spike triggers barrier dysfunction and vascular leak via integrins and TGF-β signaling. Nature Communications, 2022; 13 (1) DOI: 10.1038/s41467-022-34910-5



