摘要:根据一项新的研究,研究人员设计了抗癌纳米颗粒,可以同时传递化疗药物和一种新的免疫疗法。
新的免疫治疗方法使研究人员发现的与免疫抑制有关的基因沉默。当与现有的化疗药物结合并包装成微小的纳米颗粒时,这种疗法缩小了结肠癌和胰腺癌小鼠模型中的肿瘤。
“我们的研究有两个创新的方面:发现了一种新的治疗靶点和一种新的纳米载体,它在免疫治疗和化疗药物的选择性传递中非常有效,”皮特药学院药学教授、UPMC希尔曼癌症中心研究员、高级作者Song Li说。“我对这项研究感到兴奋,因为它具有高度的转译性。我们还不知道我们的方法是否对患者有效,但我们的研究结果表明,有很大的潜力。”
化疗是癌症治疗的支柱,但残留的癌细胞会持续存在并导致肿瘤复发。这个过程涉及到一种叫做磷脂酰丝氨酸(PS)的脂质,这种脂质通常存在于肿瘤细胞膜的内层,但在化疗药物的作用下会迁移到细胞表面。在表面上,PS起到免疫抑制剂的作用,保护剩余的癌细胞免受免疫系统的伤害。
皮特大学的研究人员发现,化疗药物氟尿嘧啶和奥铂(FuOXP)的治疗导致Xkr8水平升高,Xkr8是一种控制细胞膜上PS分布的蛋白质。这一发现表明,阻断Xkr8可以阻止癌细胞将PS分流到细胞表面,从而允许免疫细胞清除化疗后残留的癌细胞。
在最近发表在《细胞报告》上的一项独立研究中,皮特大学免疫学助理教授Yi-Nan Gong博士也将Xkr8确定为一种新的治疗靶点,以促进抗肿瘤免疫反应。

图1 科学家将Xkr8确定为一种新的治疗靶点,以促进抗肿瘤免疫反应(图源:[1])
这一团队设计了一种被称为短干扰RNA (siRNA)的遗传密码片段,它可以停止特定蛋白质的生产——在本例中是Xkr8。将siRNA和FuOXP打包成双作用纳米颗粒后,下一步是将它们靶向于肿瘤。
纳米颗粒通常太大,无法穿过健康组织中完整的血管,但它们可以到达癌细胞,因为肿瘤有时血管发育不良,有小孔,允许它们通过。但是这种靶向肿瘤的方法是有限的,因为许多人类肿瘤没有足够大的孔让纳米颗粒通过。
“就像渡船载着人们从河的一边到另一边,我们想开发一种机制,让纳米颗粒不依赖于孔穿过完整的血管,”Li说。
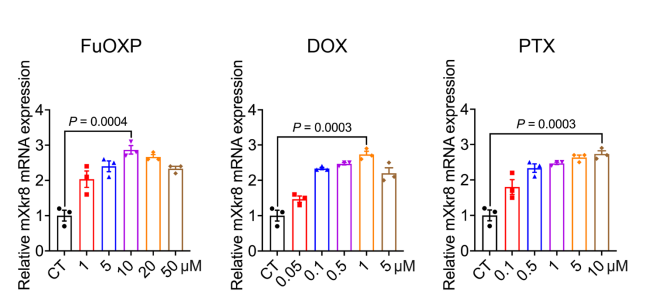
图2 不同化疗药物对Xkr8的诱导作用(图源:[1])
为了开发这样的渡轮,研究人员用硫酸软骨素和聚乙二醇装饰纳米颗粒的表面。这些化合物通过与肿瘤血管和肿瘤细胞上常见的细胞受体结合,延长它们在血流中的停留时间,帮助纳米颗粒靶向肿瘤,避开健康组织。
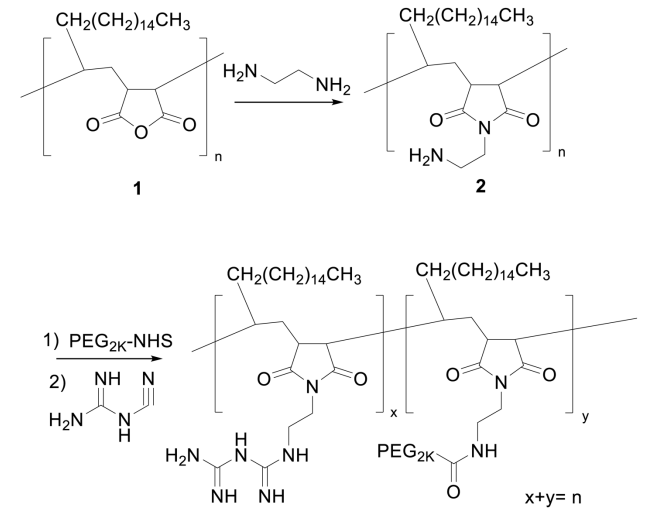
图3 PMBOP聚合物的合成方案(图源:[1])
当注射到小鼠体内时,大约10%的纳米颗粒会到达小鼠的肿瘤,这比大多数其他纳米载体平台都有显著改进。此前一项对已发表研究的分析发现,平均而言,只有0.7%的纳米颗粒剂量达到了目标。
与单独含有化学药物FuOXP的纳米颗粒相比,双作用纳米颗粒显著减少了免疫抑制PS向细胞表面的迁移。
接下来,研究人员在结肠癌和胰腺癌小鼠模型中测试了他们的平台。与接受安慰剂或FuOXP剂量的动物相比,接受含有FuOXP和siRNA的纳米颗粒治疗的动物具有更好的肿瘤微环境,有更多的抗癌T细胞和较少的免疫抑制调节性T细胞。
结果,与只接受一种治疗的小鼠相比,接受siRNA-FuOXP纳米颗粒的小鼠肿瘤大小显著减小。
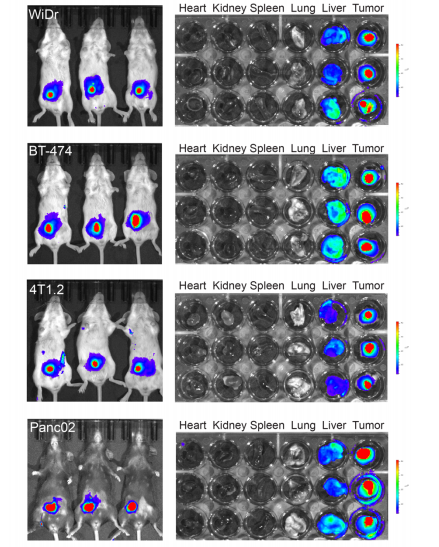
图4 PMBOP-CP NPs 214针对不同肿瘤模型的体内肿瘤靶向效率比较(图源:[1])
Li表示,该研究还指出了将FuOXP-siRNA纳米颗粒与另一种名为检查点抑制剂的免疫疗法结合的潜力。PD-1等免疫检查点就像免疫系统的刹车,但检查点抑制剂的作用是释放刹车,帮助免疫细胞对抗癌症。
研究人员发现,含siRNA或不含siRNA的FuOXP纳米颗粒增加了PD-1的表达。但当他们加入PD-1抑制剂药物时,这种联合疗法在小鼠体内的肿瘤生长和存活方面有显著改善。
他们的目标是将他们的新疗法转化为临床,该团队现在正在通过更多的实验来验证他们的发现,并进一步评估潜在的副作用。
参考资料:
[1] Targeting Xkr8 via nanoparticle-mediated in situ co-delivery of siRNA and chemotherapy drugs for cancer immunochemotherapy
摘要:根据一项新的研究,研究人员设计了抗癌纳米颗粒,可以同时传递化疗药物和一种新的免疫疗法。
新的免疫治疗方法使研究人员发现的与免疫抑制有关的基因沉默。当与现有的化疗药物结合并包装成微小的纳米颗粒时,这种疗法缩小了结肠癌和胰腺癌小鼠模型中的肿瘤。
“我们的研究有两个创新的方面:发现了一种新的治疗靶点和一种新的纳米载体,它在免疫治疗和化疗药物的选择性传递中非常有效,”皮特药学院药学教授、UPMC希尔曼癌症中心研究员、高级作者Song Li说。“我对这项研究感到兴奋,因为它具有高度的转译性。我们还不知道我们的方法是否对患者有效,但我们的研究结果表明,有很大的潜力。”
化疗是癌症治疗的支柱,但残留的癌细胞会持续存在并导致肿瘤复发。这个过程涉及到一种叫做磷脂酰丝氨酸(PS)的脂质,这种脂质通常存在于肿瘤细胞膜的内层,但在化疗药物的作用下会迁移到细胞表面。在表面上,PS起到免疫抑制剂的作用,保护剩余的癌细胞免受免疫系统的伤害。
皮特大学的研究人员发现,化疗药物氟尿嘧啶和奥铂(FuOXP)的治疗导致Xkr8水平升高,Xkr8是一种控制细胞膜上PS分布的蛋白质。这一发现表明,阻断Xkr8可以阻止癌细胞将PS分流到细胞表面,从而允许免疫细胞清除化疗后残留的癌细胞。
在最近发表在《细胞报告》上的一项独立研究中,皮特大学免疫学助理教授Yi-Nan Gong博士也将Xkr8确定为一种新的治疗靶点,以促进抗肿瘤免疫反应。

图1 科学家将Xkr8确定为一种新的治疗靶点,以促进抗肿瘤免疫反应(图源:[1])
这一团队设计了一种被称为短干扰RNA (siRNA)的遗传密码片段,它可以停止特定蛋白质的生产——在本例中是Xkr8。将siRNA和FuOXP打包成双作用纳米颗粒后,下一步是将它们靶向于肿瘤。
纳米颗粒通常太大,无法穿过健康组织中完整的血管,但它们可以到达癌细胞,因为肿瘤有时血管发育不良,有小孔,允许它们通过。但是这种靶向肿瘤的方法是有限的,因为许多人类肿瘤没有足够大的孔让纳米颗粒通过。
“就像渡船载着人们从河的一边到另一边,我们想开发一种机制,让纳米颗粒不依赖于孔穿过完整的血管,”Li说。

图2 不同化疗药物对Xkr8的诱导作用(图源:[1])
为了开发这样的渡轮,研究人员用硫酸软骨素和聚乙二醇装饰纳米颗粒的表面。这些化合物通过与肿瘤血管和肿瘤细胞上常见的细胞受体结合,延长它们在血流中的停留时间,帮助纳米颗粒靶向肿瘤,避开健康组织。

图3 PMBOP聚合物的合成方案(图源:[1])
当注射到小鼠体内时,大约10%的纳米颗粒会到达小鼠的肿瘤,这比大多数其他纳米载体平台都有显著改进。此前一项对已发表研究的分析发现,平均而言,只有0.7%的纳米颗粒剂量达到了目标。
与单独含有化学药物FuOXP的纳米颗粒相比,双作用纳米颗粒显著减少了免疫抑制PS向细胞表面的迁移。
接下来,研究人员在结肠癌和胰腺癌小鼠模型中测试了他们的平台。与接受安慰剂或FuOXP剂量的动物相比,接受含有FuOXP和siRNA的纳米颗粒治疗的动物具有更好的肿瘤微环境,有更多的抗癌T细胞和较少的免疫抑制调节性T细胞。
结果,与只接受一种治疗的小鼠相比,接受siRNA-FuOXP纳米颗粒的小鼠肿瘤大小显著减小。

图4 PMBOP-CP NPs 214针对不同肿瘤模型的体内肿瘤靶向效率比较(图源:[1])
Li表示,该研究还指出了将FuOXP-siRNA纳米颗粒与另一种名为检查点抑制剂的免疫疗法结合的潜力。PD-1等免疫检查点就像免疫系统的刹车,但检查点抑制剂的作用是释放刹车,帮助免疫细胞对抗癌症。
研究人员发现,含siRNA或不含siRNA的FuOXP纳米颗粒增加了PD-1的表达。但当他们加入PD-1抑制剂药物时,这种联合疗法在小鼠体内的肿瘤生长和存活方面有显著改善。
他们的目标是将他们的新疗法转化为临床,该团队现在正在通过更多的实验来验证他们的发现,并进一步评估潜在的副作用。
参考资料:
[1] Targeting Xkr8 via nanoparticle-mediated in situ co-delivery of siRNA and chemotherapy drugs for cancer immunochemotherapy



