摘要:马里兰大学医学院(UMSOM)精确疾病建模中心的研究人员确定了导致COVID-19的SARS-CoV-2病毒中的一种特定蛋白质是如何损害心脏组织的。然后他们使用一种药物来逆转这种蛋白质对心脏的毒性作用。
马里兰大学医学院(UMSOM)精确疾病建模中心的研究人员确定了导致COVID-19的SARS-CoV-2病毒中的一种特定蛋白质是如何损害心脏组织的。然后他们使用一种药物来逆转这种蛋白质对心脏的毒性作用。
他们的发现是基于对果蝇和小鼠心脏细胞的研究,发表于2022年9月30日的Communications Biology。

图1 研究人员确定了SARS-CoV-2病毒中的特定蛋白质如何损害心脏组织(图源:[1])
与未感染病毒的人相比,感染COVID-19的人在感染后至少一年内发生心肌炎症、心律异常、血凝块、中风、心脏病发作和心力衰竭的风险明显更高。尽管科学家们迅速开发出疫苗和药物来减轻COVID-19疾病的严重程度,但这些疗法并不能保护心脏或其他器官免受即使是轻微感染也可能造成的损害。
“要长期治疗患者,我们必须首先了解导致疾病的机制。我们的研究表明,单个的SARS-CoV-2蛋白质都可以对身体的特定组织造成重大损害,这与对其他病毒如艾滋病毒和寨卡病毒的发现类似,”高级作者、医学教授、密歇根大学医学院精确疾病建模中心主任Zhe Han博士说。“通过识别每个组织中的这些损伤过程,我们可以测试药物,看看是否有任何药物可以逆转这种损伤;那些表现出希望的药物可以在临床研究研究中进一步测试。”
去年,Han博士和他的研究团队在使用果蝇和人类细胞的研究中发现了毒性最强的SARS-CoV-2蛋白。他们发现了一种很有前途的药物selinexor降低了其中一种蛋白质的毒性,但没有降低另一种被称为Nsp6的蛋白质的毒性。
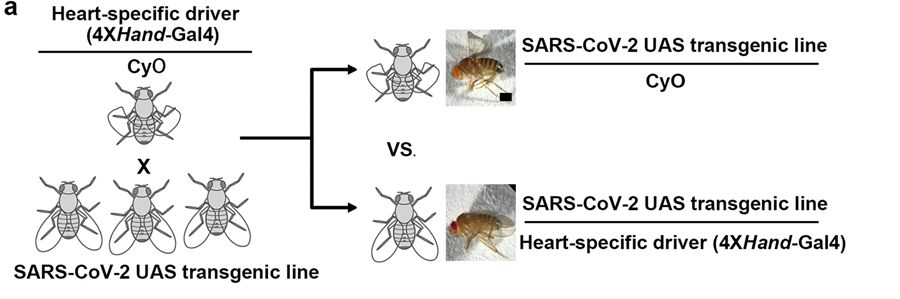
图2 遗传筛选示意图,通过心脏病理学识别特定的SARS-CoV-2基因(图源:[1])
在他们最新的研究中,他们发现Nsp6是果蝇心脏中毒性最大的SARS-CoV-2蛋白。接下来,他们发现Nsp6蛋白质劫持了果蝇心脏中的细胞,启动糖酵解过程,使细胞燃烧葡萄糖为能量。通常情况下,心脏细胞使用脂肪酸作为能量来源,但在心力衰竭时,这些细胞会转换到糖代谢,试图修复受损组织。研究人员还发现,Nsp6蛋白破坏了细胞的动力源——线粒体,线粒体通过糖代谢产生能量,从而增加了损伤。
然后,研究小组使用2-脱氧葡萄糖(2DG)阻断果蝇和小鼠心脏细胞的糖代谢。他们发现这种药物减少了由Nsp6病毒蛋白引起的心脏和线粒体损伤。

图3 UAS-SARS-CoV-2Nsp6转基因的4XH和Gal4、成纤维细胞特异性过表达(OE)诱导的成人心脏表型(图源:[1])
“我们知道,一些病毒劫持受感染动物的细胞机制,改变其新陈代谢,窃取细胞的能量来源,所以我们怀疑SARS-CoV-2做了类似的事情。病毒还可以利用糖代谢的副产品作为制造更多病毒的基石,”Han博士说。“因此,我们预测这种将心脏新陈代谢改变到感染前的药物对病毒是有害的,因为它既切断了病毒的能量供应,也消除了病毒复制所需的片段。”
研究人员说,幸运的是,2DG很便宜,在实验室研究中经常使用。尽管2DG尚未获得美国食品和药物管理局的批准用于治疗疾病,但该药物目前正在印度进行治疗COVID-19的临床试验。
很多从COVID康复的美国人在几周或几个月后出现了危险的心脏疾病,我们需要了解发生这种情况的根本原因。随着这项研究阐明了Nsp6蛋白的途径,我们可以为未来的研究改进我们的治疗目标,最终目标是逆转这些患者的进一步心脏损伤。
参考资料:
[1] SARS-CoV-2 Nsp6 damages Drosophila heart and mouse cardiomyocytes through MGA/MAX complex-mediated increased glycolysis
摘要:马里兰大学医学院(UMSOM)精确疾病建模中心的研究人员确定了导致COVID-19的SARS-CoV-2病毒中的一种特定蛋白质是如何损害心脏组织的。然后他们使用一种药物来逆转这种蛋白质对心脏的毒性作用。
马里兰大学医学院(UMSOM)精确疾病建模中心的研究人员确定了导致COVID-19的SARS-CoV-2病毒中的一种特定蛋白质是如何损害心脏组织的。然后他们使用一种药物来逆转这种蛋白质对心脏的毒性作用。
他们的发现是基于对果蝇和小鼠心脏细胞的研究,发表于2022年9月30日的Communications Biology。

图1 研究人员确定了SARS-CoV-2病毒中的特定蛋白质如何损害心脏组织(图源:[1])
与未感染病毒的人相比,感染COVID-19的人在感染后至少一年内发生心肌炎症、心律异常、血凝块、中风、心脏病发作和心力衰竭的风险明显更高。尽管科学家们迅速开发出疫苗和药物来减轻COVID-19疾病的严重程度,但这些疗法并不能保护心脏或其他器官免受即使是轻微感染也可能造成的损害。
“要长期治疗患者,我们必须首先了解导致疾病的机制。我们的研究表明,单个的SARS-CoV-2蛋白质都可以对身体的特定组织造成重大损害,这与对其他病毒如艾滋病毒和寨卡病毒的发现类似,”高级作者、医学教授、密歇根大学医学院精确疾病建模中心主任Zhe Han博士说。“通过识别每个组织中的这些损伤过程,我们可以测试药物,看看是否有任何药物可以逆转这种损伤;那些表现出希望的药物可以在临床研究研究中进一步测试。”
去年,Han博士和他的研究团队在使用果蝇和人类细胞的研究中发现了毒性最强的SARS-CoV-2蛋白。他们发现了一种很有前途的药物selinexor降低了其中一种蛋白质的毒性,但没有降低另一种被称为Nsp6的蛋白质的毒性。

图2 遗传筛选示意图,通过心脏病理学识别特定的SARS-CoV-2基因(图源:[1])
在他们最新的研究中,他们发现Nsp6是果蝇心脏中毒性最大的SARS-CoV-2蛋白。接下来,他们发现Nsp6蛋白质劫持了果蝇心脏中的细胞,启动糖酵解过程,使细胞燃烧葡萄糖为能量。通常情况下,心脏细胞使用脂肪酸作为能量来源,但在心力衰竭时,这些细胞会转换到糖代谢,试图修复受损组织。研究人员还发现,Nsp6蛋白破坏了细胞的动力源——线粒体,线粒体通过糖代谢产生能量,从而增加了损伤。
然后,研究小组使用2-脱氧葡萄糖(2DG)阻断果蝇和小鼠心脏细胞的糖代谢。他们发现这种药物减少了由Nsp6病毒蛋白引起的心脏和线粒体损伤。

图3 UAS-SARS-CoV-2Nsp6转基因的4XH和Gal4、成纤维细胞特异性过表达(OE)诱导的成人心脏表型(图源:[1])
“我们知道,一些病毒劫持受感染动物的细胞机制,改变其新陈代谢,窃取细胞的能量来源,所以我们怀疑SARS-CoV-2做了类似的事情。病毒还可以利用糖代谢的副产品作为制造更多病毒的基石,”Han博士说。“因此,我们预测这种将心脏新陈代谢改变到感染前的药物对病毒是有害的,因为它既切断了病毒的能量供应,也消除了病毒复制所需的片段。”
研究人员说,幸运的是,2DG很便宜,在实验室研究中经常使用。尽管2DG尚未获得美国食品和药物管理局的批准用于治疗疾病,但该药物目前正在印度进行治疗COVID-19的临床试验。
很多从COVID康复的美国人在几周或几个月后出现了危险的心脏疾病,我们需要了解发生这种情况的根本原因。随着这项研究阐明了Nsp6蛋白的途径,我们可以为未来的研究改进我们的治疗目标,最终目标是逆转这些患者的进一步心脏损伤。
参考资料:
[1] SARS-CoV-2 Nsp6 damages Drosophila heart and mouse cardiomyocytes through MGA/MAX complex-mediated increased glycolysis



