摘要:西奈山的研究人员已经将人类一生中RNA被修改的数千个大脑位点编入目录,这一过程被称为腺苷到肌苷(a -to-i)编辑,为理解大脑发育的细胞和分子机制以及它们如何影响健康和疾病提供了重要的新途径。
西奈山的研究人员已经将人类一生中RNA被修改的数千个大脑位点编入目录,这一过程被称为腺苷到肌苷(a -to-i)编辑,为理解大脑发育的细胞和分子机制以及它们如何影响健康和疾病提供了重要的新途径。
在《细胞报告》(Cell Reports)上发表的一项研究中,该团队描述了随着个体年龄的增长,大脑中RNA编辑的速度是如何增加的,这对分析一系列神经发育和衰老障碍中a -to- i编辑改变的病理有一定的意义。

图1 研究发现随着年龄增长大脑中RNA编辑的速度是如何增加
西奈山伊坎医学院精神病学、遗传学和基因组科学助理教授、西维尔自闭症研究和治疗中心成员迈克尔·布林博士说:“我们的工作为通过a -to- i编辑在人类大脑发育过程中RNA修饰的贡献提供了更细致和准确的见解。”“该领域已经确定了大脑中数百万个A-to-I位点,这使得确定其中哪些位点可能具有生理重要性变得尤为具有挑战性。”我们将范围缩小到大约10,000个位点,这些位点具有从胎儿早期发育到晚期衰老的潜在功能作用。通过提供这些位点的图谱,我们已经打开了通过A-to-I RNA修饰进一步了解大脑神经发育的大门。”
DNA掌握着人类和其他生物的基因蓝图,但RNA实际上是执行指令来创造功能性蛋白质。积累在RNA上的修饰可以改变蛋白质最终的功能。ADAR酶家族引入了这些单独的A-to- i变化。在胎儿早期发育过程中,通过调节大脑中的突触传递和神经元信号,其中的少数编辑起着重要的生理作用。这项研究表明,在人类的一生中,大脑中的RNA积累了成千上万个单独的编辑,而这些变化很可能随着我们年龄的增长而产生功能上的后果。
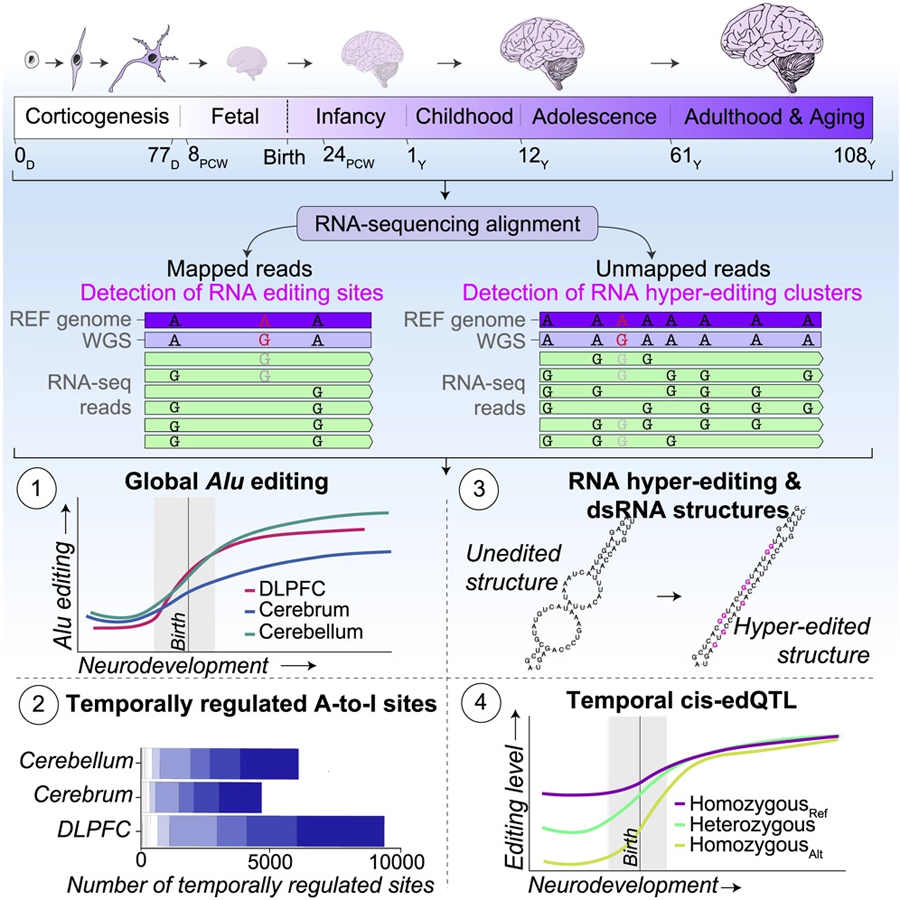
图2 Alu编辑活动受到严格调控,并在整个神经发育过程中增加
西奈山的研究生成并编译了超过800人的大脑rna序列数据。这些数据涵盖了产前和产后发育的所有阶段,从最早的胚胎祖细胞到百岁老人功能独特的脑组织。这一广泛的研究使研究人员能够开发出一种模型,首次描述a -to- i编辑在一生中是如何演变的。在这种模式中,未编辑的RNA在胎儿发育时期被表达,并可能被翻译成蛋白质,而编辑过的RNA在成人大脑中更丰富。
布林博士指出:“这意味着在年龄较大的时候,a -to- i编辑的编辑率和频率通常更高,包括稳定RNA结构和调节RNA与microrna相互作用的方式。”他的研究团队还了解到,这些a -to- i位点的一个子集将新的氨基酸替换引入大脑的蛋白质编码区域,这一事件被称为RNA重新编码。这是一个特别重要的发现,因为RNA编码对蛋白质有直接的功能和/或结构影响。
西奈山的研究小组还试图回答这样一个问题:随着个体年龄的增长,基因变异可能如何解释A-to-I编辑的一些差异。他们了解到,由于编辑位点在胎儿早期发育期间受到强烈调控,基于独特的遗传变异,数千个位点的编辑水平存在显著差异。这种区别在出生后的发育过程中逐渐消失。从基础科学的角度来看,研究人员发现的动态调节位点为未来通过a -to- i编辑操纵早期大脑发育的基本机制提供了许多途径。
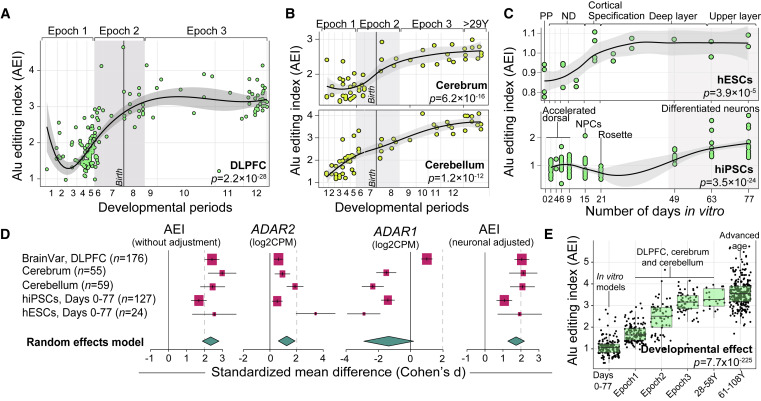
图3 人类大脑发育和神经元成熟过程中的Alu编辑指数
布林的实验室研究领域涉及功能基因组学、计算生物学和神经科学,他此前的研究发现,患有神经发育障碍的个体的脑组织中,A-to-I编辑被打乱了。
他说:“这项工作为我们提供了分析一系列神经发育和衰老障碍中a -to- i编辑改变的病理影响的直接途径。”“现在比以往任何时候都更清楚,阐明RNA编辑的动态调节可以为它们在促进健康和疾病方面的作用提供独特的见解。”
参考资料:
[1] Spatiotemporal and genetic regulation of A-to-I editing throughout human brain development
摘要:西奈山的研究人员已经将人类一生中RNA被修改的数千个大脑位点编入目录,这一过程被称为腺苷到肌苷(a -to-i)编辑,为理解大脑发育的细胞和分子机制以及它们如何影响健康和疾病提供了重要的新途径。
西奈山的研究人员已经将人类一生中RNA被修改的数千个大脑位点编入目录,这一过程被称为腺苷到肌苷(a -to-i)编辑,为理解大脑发育的细胞和分子机制以及它们如何影响健康和疾病提供了重要的新途径。
在《细胞报告》(Cell Reports)上发表的一项研究中,该团队描述了随着个体年龄的增长,大脑中RNA编辑的速度是如何增加的,这对分析一系列神经发育和衰老障碍中a -to- i编辑改变的病理有一定的意义。

图1 研究发现随着年龄增长大脑中RNA编辑的速度是如何增加
西奈山伊坎医学院精神病学、遗传学和基因组科学助理教授、西维尔自闭症研究和治疗中心成员迈克尔·布林博士说:“我们的工作为通过a -to- i编辑在人类大脑发育过程中RNA修饰的贡献提供了更细致和准确的见解。”“该领域已经确定了大脑中数百万个A-to-I位点,这使得确定其中哪些位点可能具有生理重要性变得尤为具有挑战性。”我们将范围缩小到大约10,000个位点,这些位点具有从胎儿早期发育到晚期衰老的潜在功能作用。通过提供这些位点的图谱,我们已经打开了通过A-to-I RNA修饰进一步了解大脑神经发育的大门。”
DNA掌握着人类和其他生物的基因蓝图,但RNA实际上是执行指令来创造功能性蛋白质。积累在RNA上的修饰可以改变蛋白质最终的功能。ADAR酶家族引入了这些单独的A-to- i变化。在胎儿早期发育过程中,通过调节大脑中的突触传递和神经元信号,其中的少数编辑起着重要的生理作用。这项研究表明,在人类的一生中,大脑中的RNA积累了成千上万个单独的编辑,而这些变化很可能随着我们年龄的增长而产生功能上的后果。

图2 Alu编辑活动受到严格调控,并在整个神经发育过程中增加
西奈山的研究生成并编译了超过800人的大脑rna序列数据。这些数据涵盖了产前和产后发育的所有阶段,从最早的胚胎祖细胞到百岁老人功能独特的脑组织。这一广泛的研究使研究人员能够开发出一种模型,首次描述a -to- i编辑在一生中是如何演变的。在这种模式中,未编辑的RNA在胎儿发育时期被表达,并可能被翻译成蛋白质,而编辑过的RNA在成人大脑中更丰富。
布林博士指出:“这意味着在年龄较大的时候,a -to- i编辑的编辑率和频率通常更高,包括稳定RNA结构和调节RNA与microrna相互作用的方式。”他的研究团队还了解到,这些a -to- i位点的一个子集将新的氨基酸替换引入大脑的蛋白质编码区域,这一事件被称为RNA重新编码。这是一个特别重要的发现,因为RNA编码对蛋白质有直接的功能和/或结构影响。
西奈山的研究小组还试图回答这样一个问题:随着个体年龄的增长,基因变异可能如何解释A-to-I编辑的一些差异。他们了解到,由于编辑位点在胎儿早期发育期间受到强烈调控,基于独特的遗传变异,数千个位点的编辑水平存在显著差异。这种区别在出生后的发育过程中逐渐消失。从基础科学的角度来看,研究人员发现的动态调节位点为未来通过a -to- i编辑操纵早期大脑发育的基本机制提供了许多途径。

图3 人类大脑发育和神经元成熟过程中的Alu编辑指数
布林的实验室研究领域涉及功能基因组学、计算生物学和神经科学,他此前的研究发现,患有神经发育障碍的个体的脑组织中,A-to-I编辑被打乱了。
他说:“这项工作为我们提供了分析一系列神经发育和衰老障碍中a -to- i编辑改变的病理影响的直接途径。”“现在比以往任何时候都更清楚,阐明RNA编辑的动态调节可以为它们在促进健康和疾病方面的作用提供独特的见解。”
参考资料:
[1] Spatiotemporal and genetic regulation of A-to-I editing throughout human brain development



