摘要:mTOR蛋白在细胞生长、增殖和存活中起着核心作用。它的活性根据营养物质和一些生长因子(包括激素)的可用性而变化。这种蛋白质与多种疾病有关,包括癌症,在癌症中它的活性经常增加。
mTOR蛋白在细胞生长、增殖和存活中起着核心作用。它的活性根据营养物质和一些生长因子(包括激素)的可用性而变化。这种蛋白质与多种疾病有关,包括癌症,在癌症中它的活性经常增加。为了更好地了解其规律,来自日内瓦大学(UNIGE)的一个团队与来自德国马丁·路德大学(MLU)的研究人员合作 已经确定了SEA复合体的结构——一组相互依赖的蛋白质——负责控制mTOR。这种结构的发现使我们能够更好地理解细胞是如何感知营养水平来调节它们的生长的。

图1 研究人员确定了SEA复合体的结构
从酵母到人类,mTOR蛋白(雷帕霉素的哺乳动物靶标)是细胞生长的中心控制者。这种蛋白质对细胞环境中的各种信号做出反应,如营养和激素,并调节许多基本的细胞功能,如蛋白质和脂质合成,线粒体产生的能量和细胞结构的组织。mTOR活性的中断是多种疾病的原因,包括糖尿病、肥胖、癫痫和各种癌症。
同一个复合体中两个相反的函数
大学理学院分子与细胞生物学系教授、国家化学生物学能力研究中心主任Robbie Loewith的实验室对mTOR的调控很感兴趣,特别是SEA复合物,它是营养物质的直接传感器,控制着mTOR的活性。SEA复合体由8种蛋白质组成。SEA复合体(SEACIT)的一部分参与了mTOR活性的抑制,而另一部分(SEACAT)则参与了mTOR活性的激活。
在缺乏营养的情况下,mTOR蛋白被SEACIT亚复合体阻塞,细胞生长因此受阻。相比之下,在营养物质存在的情况下,SEACAT亚复合体被认为能够抑制SEACIT亚复合体,从而不再能够阻断mTOR蛋白。中央控制器可以在细胞生长中发挥其激活作用,例如,通过刺激蛋白质和脂类的产生。SEACAT如何调控SEACIT还不清楚。
确定结构以理解功能
为了确定SEA复合体蛋白质之间的相互作用,从而更好地理解它们是如何工作的,研究人员开始确定这种复合体的结构。在生物化学方法将SEA复合物从细胞中的所有其他成分中分离出来后,科学家们使用了UNIGE、UNIL和EPFL的杜波切特成像中心的技术,通过低温电子显微镜(cryo-EM)获得了它的分子结构。
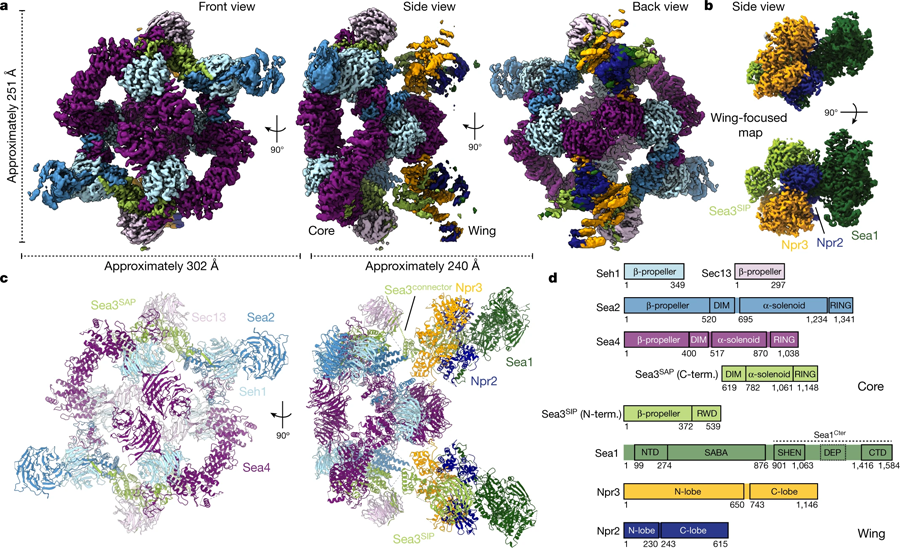
图2 SEA复合体的低温电子显微镜(Cryo-EM)结构
分子与细胞生物学系的研究员、该研究的第一作者Lucas Tafur解释说:“通过在-180°C下非常快速地冷冻样本,低温电镜可以获得蛋白质原始状态下的结构,即它们的功能三维形式。”
SEACAT是必要的,但不是充分的
然后在实验室中测试该复合物不同成分的生化活性。尽管SEACAT亚复合体以活性形式存在(当有营养物质存在时),研究人员观察到SEACIT亚复合体仍然是活性的,能够阻断mTOR。“这一结果非常出乎意料,因为SEACAT一直被描述为SEACIT的直接抑制剂。因此,我们预期SEACIT在活跃的SEACAT存在时是不活跃的。我们的研究结果表明,SEACAT更多的是作为招募其他调控蛋白的支架,因此它的存在对于抑制SEACIT是必要的,但不是充分的,”该研究的最后一位作者Robbie Loewith解释道。
获得SEA复合体的结构可以突出mTOR调控级联中缺失的环节。“当然,我们现在需要确定与这个综合体有关的未知伙伴。这些新的因子可能被证明是mTOR活性加剧的肿瘤的治疗靶点,”Lucas Tafur总结道。
参考资料:
[1] Cryo-EM structure of the SEA complex
摘要:mTOR蛋白在细胞生长、增殖和存活中起着核心作用。它的活性根据营养物质和一些生长因子(包括激素)的可用性而变化。这种蛋白质与多种疾病有关,包括癌症,在癌症中它的活性经常增加。
mTOR蛋白在细胞生长、增殖和存活中起着核心作用。它的活性根据营养物质和一些生长因子(包括激素)的可用性而变化。这种蛋白质与多种疾病有关,包括癌症,在癌症中它的活性经常增加。为了更好地了解其规律,来自日内瓦大学(UNIGE)的一个团队与来自德国马丁·路德大学(MLU)的研究人员合作 已经确定了SEA复合体的结构——一组相互依赖的蛋白质——负责控制mTOR。这种结构的发现使我们能够更好地理解细胞是如何感知营养水平来调节它们的生长的。

图1 研究人员确定了SEA复合体的结构
从酵母到人类,mTOR蛋白(雷帕霉素的哺乳动物靶标)是细胞生长的中心控制者。这种蛋白质对细胞环境中的各种信号做出反应,如营养和激素,并调节许多基本的细胞功能,如蛋白质和脂质合成,线粒体产生的能量和细胞结构的组织。mTOR活性的中断是多种疾病的原因,包括糖尿病、肥胖、癫痫和各种癌症。
同一个复合体中两个相反的函数
大学理学院分子与细胞生物学系教授、国家化学生物学能力研究中心主任Robbie Loewith的实验室对mTOR的调控很感兴趣,特别是SEA复合物,它是营养物质的直接传感器,控制着mTOR的活性。SEA复合体由8种蛋白质组成。SEA复合体(SEACIT)的一部分参与了mTOR活性的抑制,而另一部分(SEACAT)则参与了mTOR活性的激活。
在缺乏营养的情况下,mTOR蛋白被SEACIT亚复合体阻塞,细胞生长因此受阻。相比之下,在营养物质存在的情况下,SEACAT亚复合体被认为能够抑制SEACIT亚复合体,从而不再能够阻断mTOR蛋白。中央控制器可以在细胞生长中发挥其激活作用,例如,通过刺激蛋白质和脂类的产生。SEACAT如何调控SEACIT还不清楚。
确定结构以理解功能
为了确定SEA复合体蛋白质之间的相互作用,从而更好地理解它们是如何工作的,研究人员开始确定这种复合体的结构。在生物化学方法将SEA复合物从细胞中的所有其他成分中分离出来后,科学家们使用了UNIGE、UNIL和EPFL的杜波切特成像中心的技术,通过低温电子显微镜(cryo-EM)获得了它的分子结构。

图2 SEA复合体的低温电子显微镜(Cryo-EM)结构
分子与细胞生物学系的研究员、该研究的第一作者Lucas Tafur解释说:“通过在-180°C下非常快速地冷冻样本,低温电镜可以获得蛋白质原始状态下的结构,即它们的功能三维形式。”
SEACAT是必要的,但不是充分的
然后在实验室中测试该复合物不同成分的生化活性。尽管SEACAT亚复合体以活性形式存在(当有营养物质存在时),研究人员观察到SEACIT亚复合体仍然是活性的,能够阻断mTOR。“这一结果非常出乎意料,因为SEACAT一直被描述为SEACIT的直接抑制剂。因此,我们预期SEACIT在活跃的SEACAT存在时是不活跃的。我们的研究结果表明,SEACAT更多的是作为招募其他调控蛋白的支架,因此它的存在对于抑制SEACIT是必要的,但不是充分的,”该研究的最后一位作者Robbie Loewith解释道。
获得SEA复合体的结构可以突出mTOR调控级联中缺失的环节。“当然,我们现在需要确定与这个综合体有关的未知伙伴。这些新的因子可能被证明是mTOR活性加剧的肿瘤的治疗靶点,”Lucas Tafur总结道。
参考资料:
[1] Cryo-EM structure of the SEA complex



