随着时代的发展,恶性肿瘤已成为人类生命健康的威胁之一,其治疗手段及效果难以保证,生存率底。近年来,免疫疗法在肿瘤治疗中起到了极大作用,其中一个重要方向就是免疫检查点抑制治疗。这种疗法在多种恶性肿瘤中的疗效已被证明,但其治疗效率往往与肿瘤抗原的水平相关。
有研究表明,RNA不完全剪接可以产生保留内含子翻译的多肽。在肿瘤细胞中,Ⅰ型主要组织相容性基因复合体(MHC I)可因此产生新的抗原而引发机体抗肿瘤免疫。有科学家认为,这种剪接衍生肽是肿瘤免疫的新表位,具有极大的治疗潜力及临床应用前景。
2021年6月24日,学术期刊《细胞》杂志在线发表了美国弗雷德哈钦森癌症研究中心Robert K. Bradley和纪念斯隆凯特琳癌症中心Omar Abdel-Wahab团队名为“Pharmacologic modulation of RNA splicing enhances anti-tumor immunity”的合作研究,该研究证实了药物干预RNA剪接对抗肿瘤免疫的增强作用。

DOI: 10.1016/j.cell.2021.05.038
研究人员假设通过药物干扰mRNA剪接可导致新多肽的表达,这些多肽可能具有抗原性,也具有成为免疫新表位的可能。他们使用降解剂对剪接因子RBM39 进行抑制,成功抑制了体内肿瘤的生长,而B2m敲除后这种抑制作用消失。这些结果表明,剪接调节对肿瘤免疫具有积极作用,且这一效应是依赖T细胞实现的。
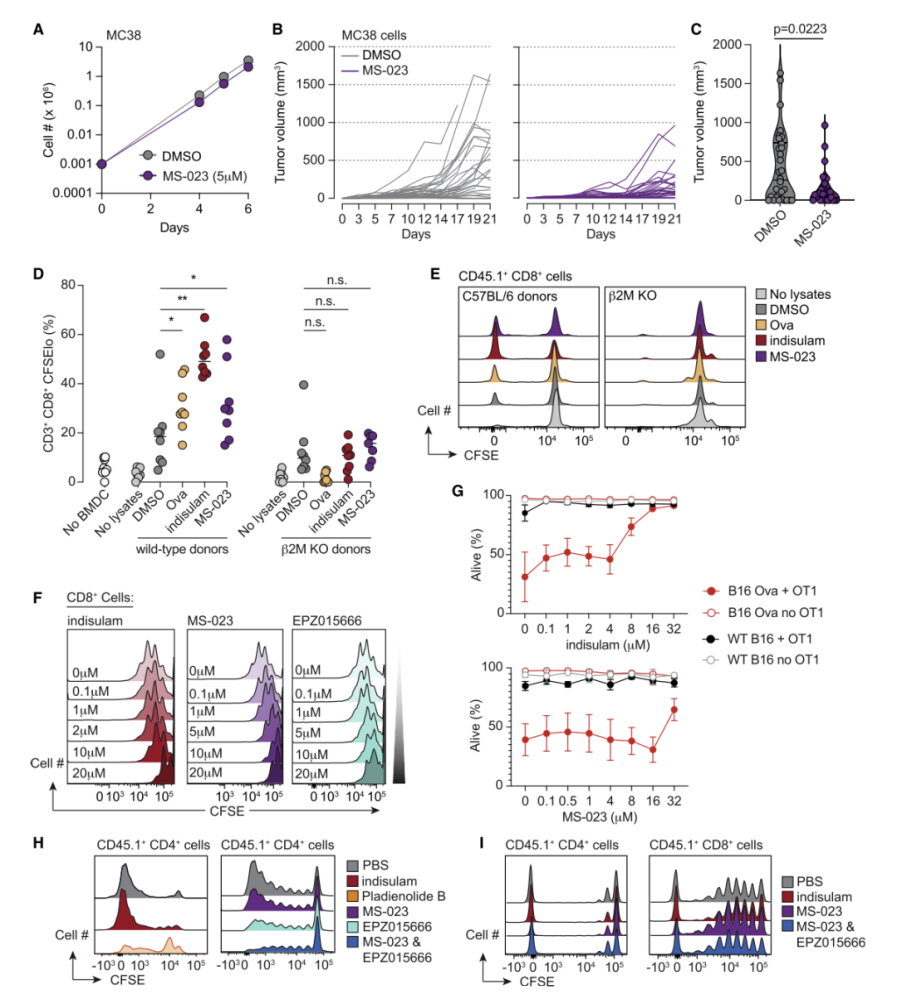
药物调节剪接促进 T 细胞反应性
为了进一步验证假设,研究人员使用剪接调节剂和(或)PD-1对接受肿瘤移植的小鼠进行治疗,结果显示:剪接调节后,免疫检查点阻断疗法的治疗效果显著增强。
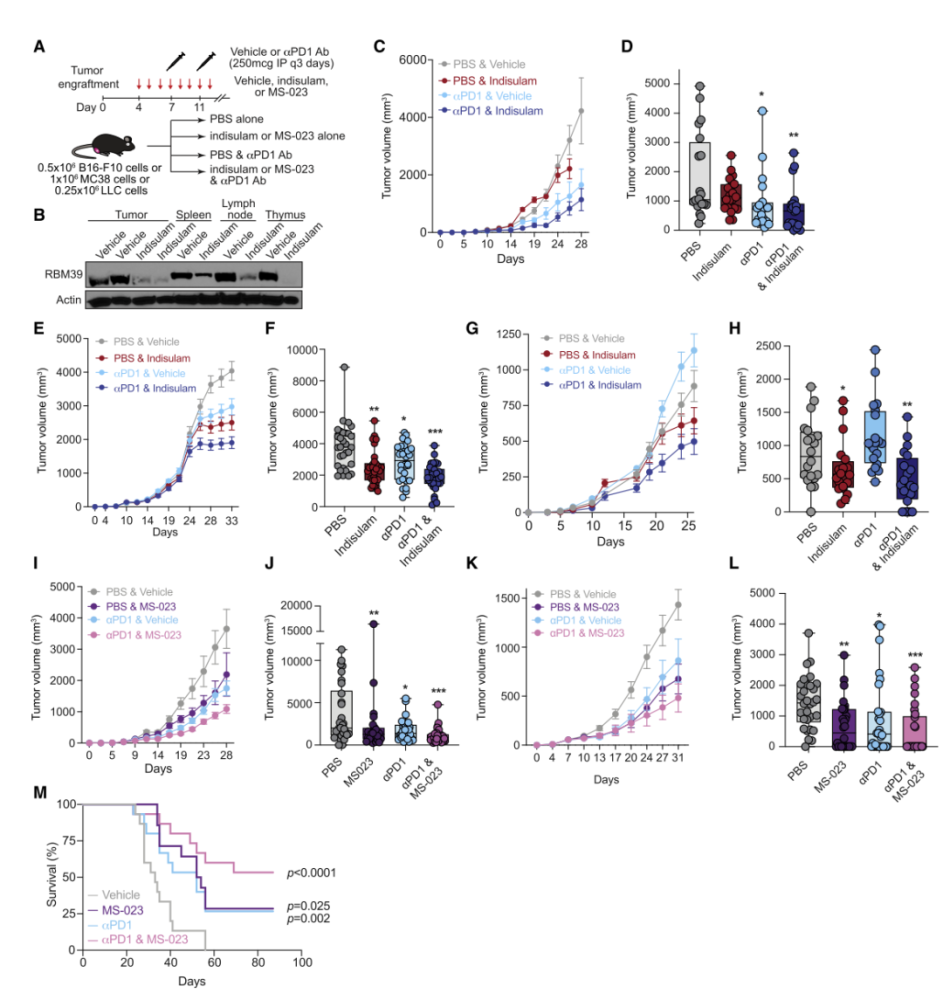
剪接调节增强检查点免疫疗法
那么,剪接调节是否通过增加抗原从而增强抗肿瘤免疫呢?研究人员通过转录组学分析剪接调节剂处理后小鼠肿瘤细胞系的转录变化,并量化了差异基因和同种型表达。结果表明,剪接调节能够诱导大量新抗原表达,导致潜在的免疫表位产生。
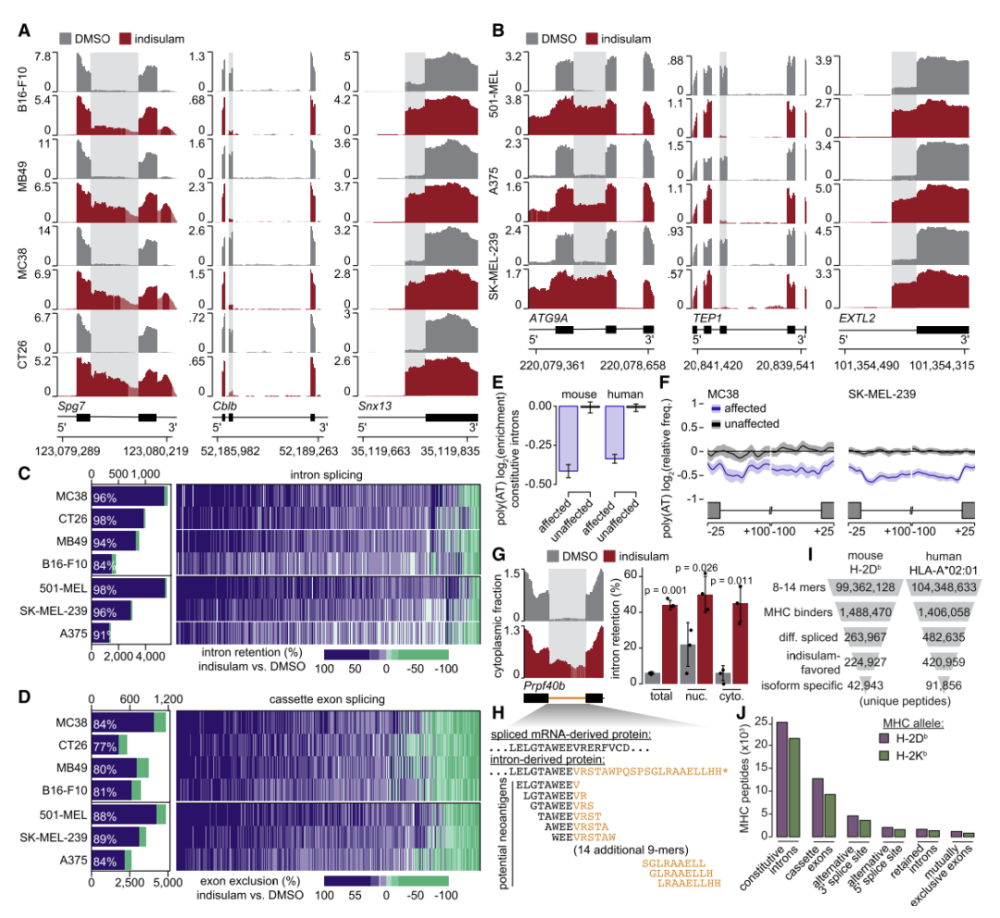
剪接调制诱导广泛的潜在新表位产生
随后,研究人员通过实验鉴定了转录组学分析中出现的新表位,并使用109种候选肽对小鼠进行免疫。不仅是这些新抗原显示出较强的免疫原性,其产生的CD8+T细胞也表现出细胞毒性活性。这一实验结果在小鼠黑色素瘤中得到验证:剪接调节剂处理后小鼠产生新型抗原肽并刺激CD8+T细胞扩增;在使用免疫检查点抑制剂共同治疗的小鼠中,CD8+ T细胞识别剪接衍生肽的频率增加。
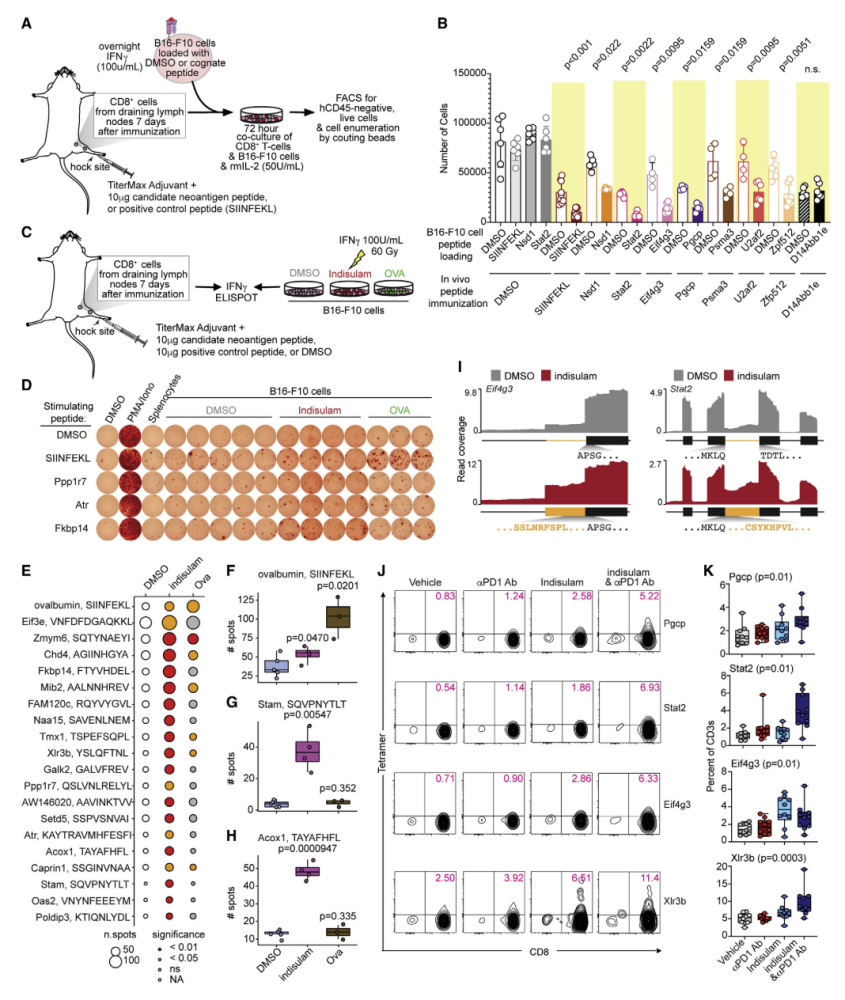
剪接衍生的新抗原触发内源性 T 细胞反应
当前研究较多的肿瘤抗原来源是基因突变,而本研究证明RNA剪接调节可作为肿瘤免疫原性肽的潜在来源,这些抗原表位具有增强免疫检查点抑制疗效的效力,且具有极大的临床转化潜能。



