RAS基因是人类较早锁定的癌症元凶,在Harvery鼠肉瘤病毒(Ha-MSV)和Kirsten鼠肉瘤病毒(Ki-MSV)的子代基因中被发现,据公开资料显示,30%的肿瘤携带RAS变异,其基因家族成员"H-RAS、K-RAS和N-RAS"中仅KRAS突变就会每年在全世界造成约100万人死亡。
然而,由于RAS蛋白结构和底物亲和力的特殊性,研究人员历经40年才打破“不可成药”的“魔咒”,今年5月,FDA对RAS 靶向疗法 AMG510 开放快速通道,加速批准上市,让我们对成功治疗 RAS 突变癌症重新燃起了希望。
尽管如此,AMG-510也仅仅能治疗RAS驱动的一小部分癌症类型,主要是由于RAS特殊的球形结构,且缺乏与小分子药物结合的“口袋”,使得药物无法攻破原癌基因堡垒,打入敌军内部。
近日,利兹大学的研究人员另辟蹊径,发现了一种靶向“RAS”突变蛋白的新方法,他们在RAS表面发现了一个"裂缝",可以用来开发新药。相关研究以RAS-inhibiting biologics identify and probe druggable pockets including an SII-α3 allosteric site为题发表于《Nature communications》杂志。

https://doi.org/10.1038/s41467-021-24316-0
2017年,利兹大学和Avacta生命科学公司合作开发了一款可代替传统基于动物源性抗体检验生物分子和生命过程的Affimer技术,该技术中的Affimer蛋白存在一种类似抗体的表面结合区域,能紧密结合靶标分子,量化其含量和活性,从而轻松并可靠地跟踪分子运动轨迹和它们对各种刺激的反应,让疾病研究更加行云流水。

DOI: 10.7554/elife.24903
在这项新的研究中,科研人员利用该技术确定了两种Affimer结合蛋白“K3 和 K6”,研究发现它们能抑制核苷酸交换、并调节下游信号通路。
不仅如此,研究人员发现它们分别寄存在近日发现的两种可成药口袋“SI/II”与“SII”中。其中Affimer K6 结合在 SI/SII口袋中,而Affimer K3则充当SII区域的非共价抑制剂,可揭示野生型 RAS 的构象异构体,并携带可成药的 SII/α3口袋。
那么“SI/II”与“SII”又是什么来头呢?研究指出,SI/II经常呆在 RAS 基因的 Switch I 和 Switch II 区域之间,该区域涉及核苷酸交换因子的结合,而SII则身处Switch II循环下,值得一提的是,目前以Switch II为靶点已经开发出了一系列RAS抑制剂。
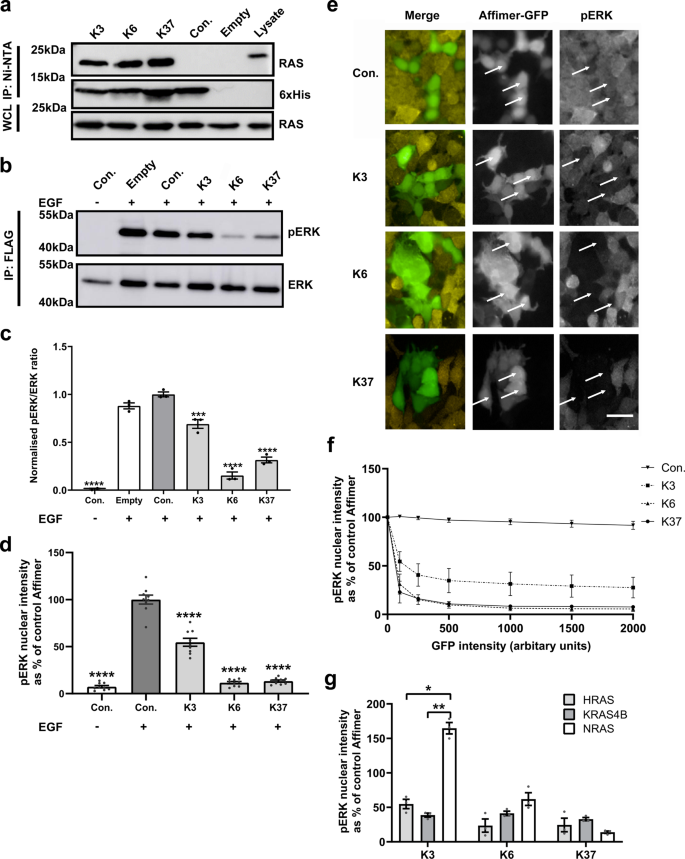
Affimers 与细胞内 RAS 结合并抑制下游信号传导
为了进一步探索Affimers识别和探测RAS基因口袋的潜力,研究人员开发出了KRAS:Affimer NanoBRET 系统,并针对SI/SII 和 SII 口袋中的小分子抑制剂对 NanoBRET 信号的影响进行评估。
研究数据显示,随着 Affimer 与KRAS基因比率的增加,NanoBRET 信号也逐渐增强,这说明K6 和 K3 在细胞内可与KRAS相互作用,且Affimers 可作为识别药效团的潜在工具。
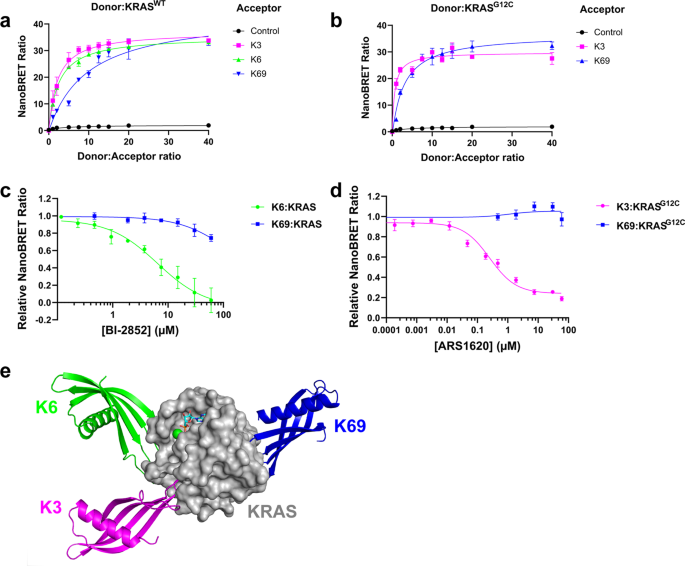
KRAS NanoBRET 可用于识别结合在 SI/SII 或 SII/α3 口袋中的小分子
该研究的作者之一、英国利兹大学的Darren C. Tomlinson博士补充说:“这项工作为治疗数百种疾病开启了纪元,我们可以有效地探测与疾病有关的蛋白质,以便在未来找到可用的药物'口袋'”。
目前,扩大针对 RAS基因的抗癌疗法的探索仍处于早期阶段,相信未来会有更多的新疗法诞生,为抗癌之路添砖加瓦。



