2017年,科学家提出肿瘤免疫调定点学说,认为特定肿瘤组织内存在一种免疫状态,即“检查点”;是宿主和环境的刺激、抑制性因素的综合,决定了免疫系统对抗肿瘤反应的程度。只有当免疫治疗的效果超过了“调定点”,治疗才算有效。
近期的宏基因组测序研究揭示,肠道微生物群是这种肿瘤免疫调定点的另一关键介质。有研究表明,在启动ICI治疗之前使用抗生素会降低晚期非小细胞肺癌患者的肠道微生物群多样性,将导致不良治疗结果。利用肠道微生物群作为ICI的治疗辅助,成为解决ICI治疗耐药的新方向。
2022年1月14日,由加拿大、瑞士和法国组成的研究团队在著名期刊Cancer Discovery发表了题为“A natural polyphenol exerts antitumor activity andcircumvents anti-PD-1 resistance through effects on the gut microbiota”的文章(图1),首次证实从卡姆果(Camu-camu, CC)中分离出来的栗木鞣花素(castalagin)通过与肠道共生细菌直接相互作用,改变了肠道微生物组成并重塑肿瘤微环境,刺激肿瘤产生更强的抗PD-1反应从而有效克服耐药问题。

卡姆果又称作卡姆梅,原产于秘鲁共和国亚马逊河上游雨林,外形似葡萄,果实直径为2-3 cm。果实成熟时呈现美丽的紫红色,果肉则几乎为半透明的白色。卡姆果中含有剂量极高的天然维生素C,其含量是柑橘类的60倍,被认为具有抗氧化、抗炎的活性。此外,近期科学家发现卡姆果还能通过增加肠道中嗜黏蛋白阿克曼菌和双歧杆菌的丰度来缓解小鼠肥胖和相关代谢紊乱,发挥保护性益生元的作用。
本研究发现,与单独治疗相比,CC和抗PD-1联合治疗更能抑制肿瘤生长。在抗PD-1治疗耐药的乳腺癌小鼠模型中,补充CC一定程度克服了耐药问题。通过进一步探索发现,CC的抗肿瘤效应依赖于肠道菌群,且能够增加微生物组的多样性,促成了微生物组的构成改变。研究人员还发现,CC的抗肿瘤活性同时也依赖于CD8+T细胞,并与免疫原性细菌与瘤胃球菌(Ruminococcus)、克里斯滕森菌科(Christensenellaceae R-7group)、嗜胆菌属(Bilophila)和嗜黏蛋白阿克曼菌(A. muciniphila)的丰度有关(图2)。
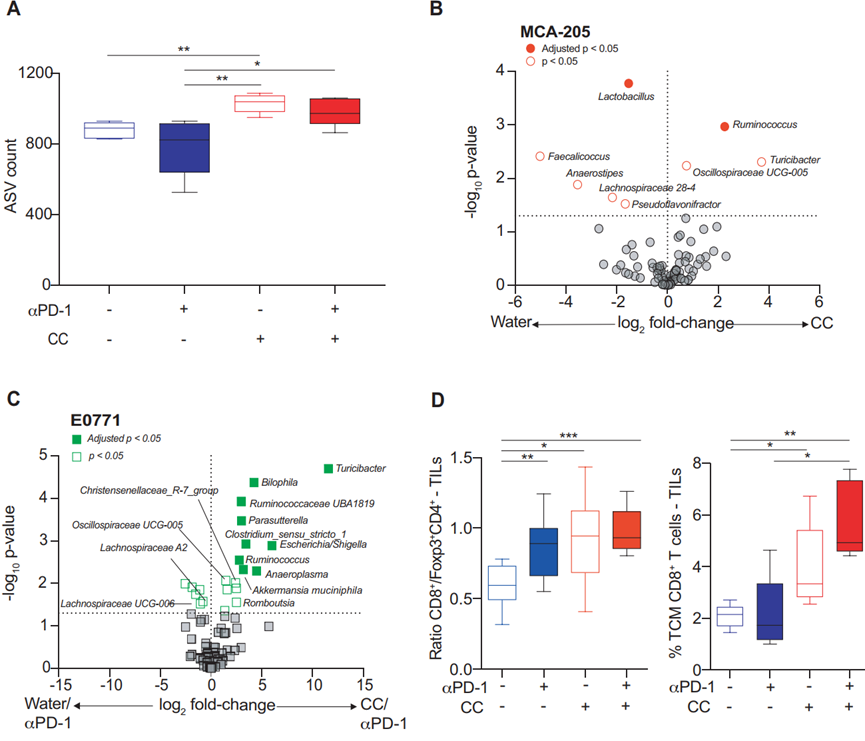
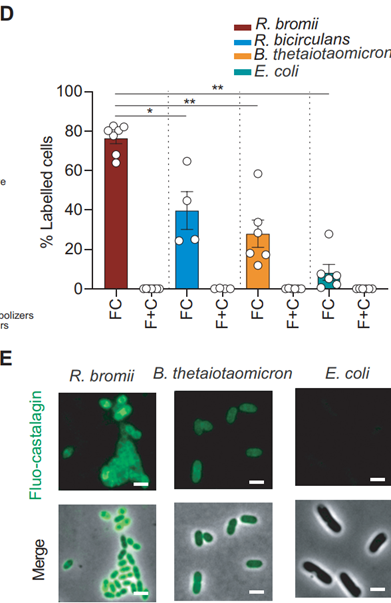
CC由超过50种化合物组成,各组分都有助于其益生元特性的维持,但影响菌群组成,发挥抗肿瘤效应的成分是什么呢?借助高效液相色谱法,该研究鉴定出CC的一种生物活性多酚——栗木鞣花素,为CC发挥抗肿瘤效应的分子基础(图3)。为了确认这一发现,该研究用栗木鞣花素重复了上述实验,证实单靠栗木鞣花素就能够改变肠道微生物组成,诱导系统性的免疫反应以及影响CD8+T细胞。进一步探究发现,栗木鞣花素可以一定程度克服抗PD-1的耐药性,且其抗肿瘤作用与瘤胃球菌丰度相关。分子机制上,栗木鞣花素优先与瘤胃球菌的细胞包膜结合,引发后续的抗肿瘤效应。
这项研究首次发现从卡姆果中分离出来的栗木鞣花素通过与共生细菌直接相互作用而具有抗肿瘤作用,从而重塑肿瘤微环境。此外,在临床前抗PD-1耐药模型中,栗木鞣花素能够重新建立了抗PD-1治疗的有效性。这是第一个证明单一多酚作为益生元具有微生物依赖的抗肿瘤作用的研究,为未来使用栗木鞣花素作为肿瘤患者的ICI辅助剂的临床试验铺平了道路。
事实上,通过人为干预改变肠道菌群以增强免疫治疗的策略已得到越来越多研究者的关注。2015年,芝加哥大学Ayelet S等人发现只需给小鼠口服双歧杆菌就能达到与抗PD‐L1免疫抑制剂同等水平的效果,而双歧杆菌和抗PD‐L1抗体联合使用可促进小鼠的抗肿瘤免疫,几乎完全抑制小鼠黑色素瘤。2020年,日本科学家发现益生菌也作为干预措施用于晚期非小细胞肺癌患者临床免疫治疗过程中,患者在免疫检查点阻断治疗期间接受丁酸梭菌MI‐YAIRI 588治疗,结果表明益生菌治疗与总生存期的延长相关。另外,双歧杆菌K57也在与PD‐1阻滞剂或奥沙利铂协同治疗中表现了良好的潜在治疗效果。总之,作为一类安全有效的微生态制剂,益生菌在干预肠道菌群增强肿瘤免疫治疗方面显示出较大的发展潜力。



