衰老伴随着细胞蛋白质稳态(proteostasis)的降低,构成许多与年龄相关的、蛋白质错误折叠疾病的病理基础。然而,衰老如何破坏蛋白平衡的机制仍不清楚。与成熟蛋白质相比,新生多肽更容易发生错误折叠,因此成为蛋白质稳态调控网络的重大负担。在翻译延伸过程中,核糖体的速度在位置上是可变的,而这些局部的变化影响着共翻译转运(蛋白质一边翻译一边转运到内质网)过程。一般认为,翻译延伸过程的一过性减慢可以促进新生蛋白的折叠、组装、细胞器靶向定位和分子伴侣招募等过程,有利于共翻译转运。然而,如果翻译延伸过程持续减慢,则可能导致核糖体碰撞和新生多肽及转录本的降解,不利于共翻译转运,会出现新生蛋白质聚集、细胞适应性受损和神经退行性改变。衰老的标志之一是蛋白质稳态的失衡,但尚不清楚衰老是否破坏了翻译延伸和共翻译转运之间的紧密平衡。
2022年1月19日,Nature杂志在线刊登了题为“Ageing exacerbates ribosome pausing to disruptcotranslational proteostasis”的文章。该研究发现,衰老过程中翻译效率的改变或有助于破坏蛋白质稳态。核糖体停顿的增加导致核糖体相关质量控制机制(ROC)超负荷及新生多肽聚集,在衰老过程中对蛋白质稳态的破坏具有重要作用。

研究者运用核糖体测序(Ribo-seq)等技术手段检测衰老是否会改变秀丽隐杆线虫和芽殖酵母衰老模型的翻译延伸过程。系列结果显示,这两种生物中与年龄相关的翻译起始减少,且核糖体停顿增加。
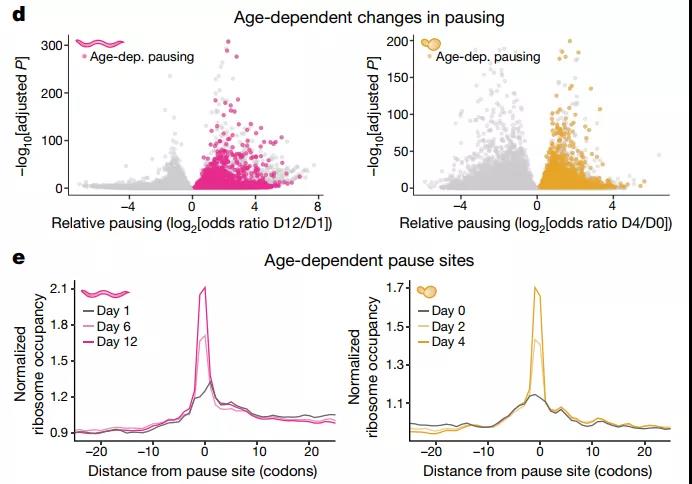
通过后续一系列相关实验,研究人员发现,在衰老的酵母和线虫的特定位置上,核糖体停顿加剧,包括多位点拉伸,导致核糖体碰撞增加,后者将触发、激活ROC通路。
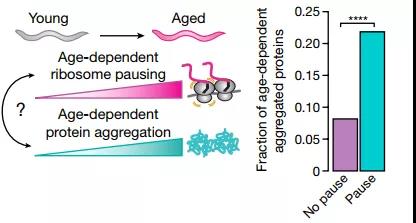
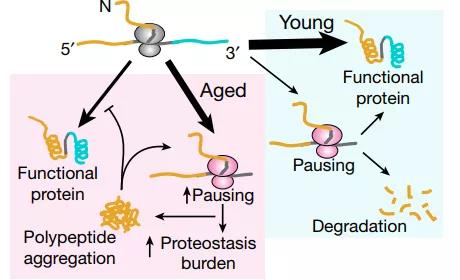
总之,这项研究将衰老过程中的核糖体停顿与共翻译转运、蛋白质稳态联系起来,证明了然停顿的增加将导致RQC超负荷新生多肽聚集,破坏蛋白质稳态,在衰老引起的全身衰退中起重要作用。



