近日,来自美国西奈山伊坎医学院的研究团队突发奇想:将肿瘤细胞永久地停留在休眠期(即细胞周期停滞于G0/G1期),一直“沉睡”下去!该研究近期发表于Nature Cancer,阐释了肿瘤微环境中的细胞外基质对肿瘤细胞进入和维持休眠状态的关键作用。

首先,研究者们从休眠肿瘤细胞的“根据地”胶原细胞外基质(ECM) 的三维结构组织着手。为此,他们将休眠型肿瘤细胞系和增殖型肿瘤细胞系通过尾静脉注射的方式接种到小鼠体内,不像增殖型肿瘤细胞在小鼠体内迅速形成肿瘤,休眠型肿瘤细胞在小鼠体内通常是以单个细胞或惰性小结节的形式存在。
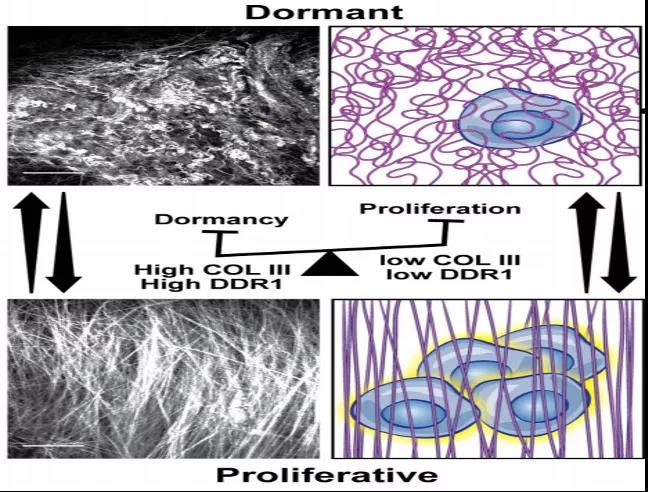
在多光子二次谐波成像下,研究结果显示,休眠细胞周围的胶原纤维具有非线性排列和波状结构的特征,并在癌细胞再活化过程中能够转换到高度的线性状态。
由于休眠性和增殖性肿瘤的ECM在结构上是不同的,因此研究者们试图通过对脱细胞化的增殖期肿瘤和处于休眠期的肿瘤进行质谱分析从而确定它们的组成或“基质体“是否不同。结果表明:休眠细胞在体内形成小结节,而增殖期肿瘤在体内形成生长中的肿瘤团块。这一差异分析显示,休眠癌细胞的基质体高度富含胶原蛋白且占比55%(其中胶原蛋白I、III、V和VI型的丰度更高),而在增殖性肿瘤中仅占基质体的36%。
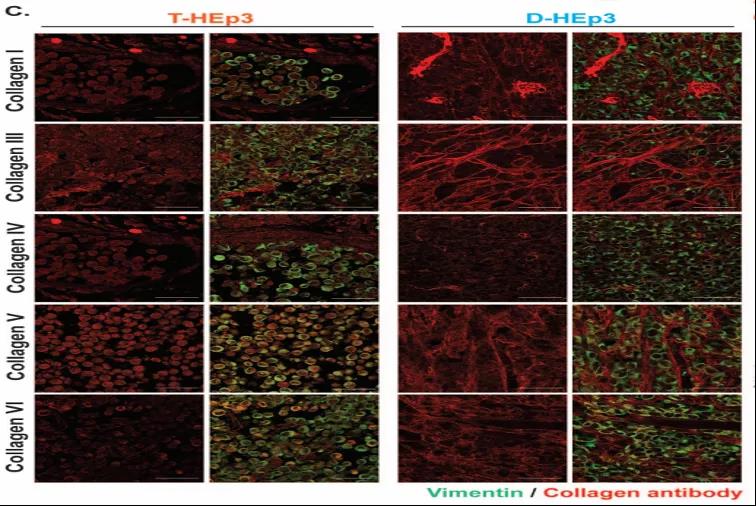
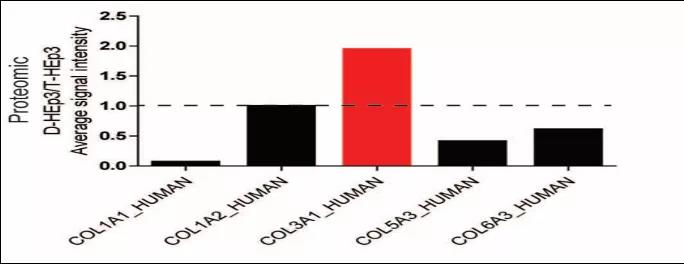
接着,研究者使用人-小鼠异种移植系统进一步确定肿瘤细胞(人类蛋白序列)和基质细胞(小鼠蛋白序列)对基质体生产的相对贡献。检测显示,与增殖细胞相比,III型胶原蛋白在休眠肿瘤细胞中较丰富。
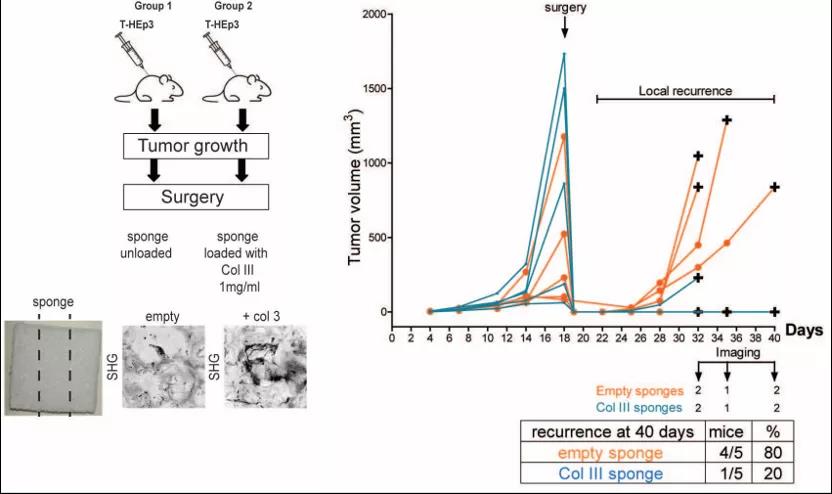
II型胶原蛋白的生物工程支架治疗局部残留的癌细胞(原发肿瘤切除后观察到的)是否可以防止残留的休眠癌细胞被唤醒呢?为此,研究使用了表达CDK2生物传感器的T-HEp3细胞,结果显示,只有20%的含支架III型胶原蛋白治疗的小鼠在肿瘤手术后复发,而对照组中80%的肿瘤复发。
由于III型胶原蛋白丰度的增加与COL3A1(癌细胞处于休眠期间运行的基因网络的一部分)在mRNA水平和蛋白水平上的高表达相关。为了确定COL3A1在维持癌细胞休眠中的作用,研究者们使用siRNA敲除了休眠D-HEp3细胞中的COL3A1并进行了体内生长实验。有趣的是,在休眠细胞中过表达的其他胶原链对肿瘤休眠没有明显的影响。而D-HEp3中COL3A1的缺失会导致休眠诱导基因NR2F1的表达显著降低。这些结果揭示了COL3A1在诱导和维持休眠中的作用。也就是说,III型胶原蛋白不但抑制肿瘤增殖、诱导肿瘤细胞进入休眠状态,同时也是肿瘤细胞维持休眠状态的关键。
研究人员发现了存在于III型胶原蛋白和休眠肿瘤细胞之间的正反馈通路:III型胶原蛋白与肿瘤细胞DDR1受体结合,激活STAT1(DDR1下游潜在的调控休眠的转录因子)入核促进COL3A1表达,然后肿瘤细胞分泌III型胶原蛋白,进而将肿瘤细胞维持在休眠状态。
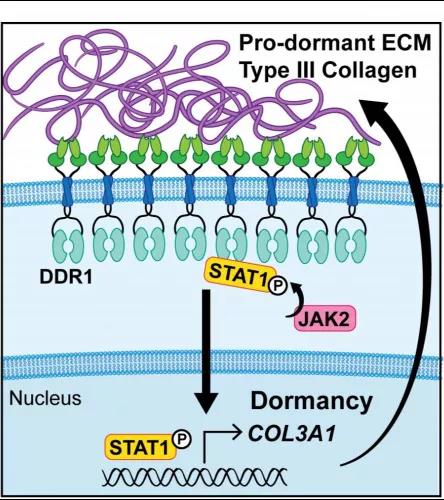
总的来说,本研究描述了一种新的细胞休眠机制:向肿瘤微环境中添加III型胶原蛋白,能够促进肿瘤细胞进入并维持在休眠状态,抑制肿瘤增殖。让我们期待在不久的将来临床上可以利用III型胶原蛋白作为检测肿瘤复发的标志物以预防肿瘤的复发和转移。



