转移(metastasis)是造成肿瘤相关死亡的主要原因。该过程涉及多个步骤,包括肿瘤细胞逃离原发肿瘤、侵入周围的间质、侵入血管或淋巴管,并在血液循环系统中存活。肿瘤细胞通过外渗的方式离开血管,在远处的器官中扩散并形成继发肿瘤。
但肿瘤细胞并不是“盲目”的,它们不会随机地侵袭继发性转移部位,相反,它们会优先在特定的器官中“定植”(seed),并选择性地创造有利于肿瘤细胞转移的微环境。这种微环境的形成是肿瘤细胞、基质细胞和细胞外基质(extracellular matrix, ECM)之间的动态相互作用的结果。ECM由胶原蛋白、弹性蛋白、纤维连接蛋白和层粘连蛋白等核心结构大分子组成,储存生长因子和生物活性分子。与正常组织的ECM不同的是,“重塑”的肿瘤ECM能为肿瘤组织提供结构基础,不仅支持肿瘤细胞的生长、生存、迁移和分化,还能协助肿瘤发生转移扩散。重塑过程需要特定因素和相关酶的活动,这些酶包括赖氨酸氧化酶(LOX)、组织蛋白酶和基质金属蛋白酶(MMPs)等。这些ECM相关酶已被报道对肿瘤的发生发展具有重要作用,但是抗肿瘤药物如何影响这些分子尚不清楚。
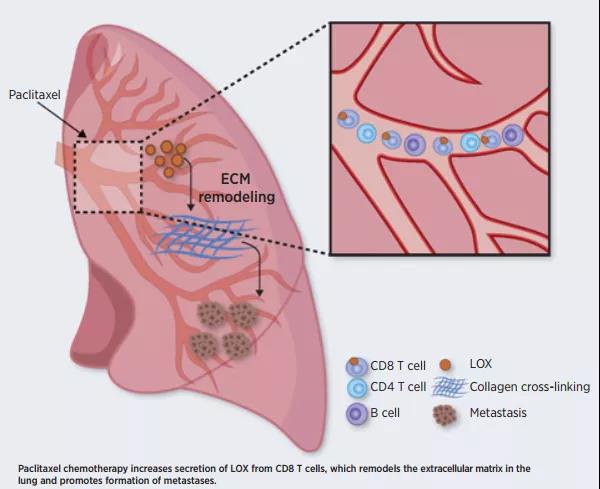
近日,以色列理工学院的Rappaport Technion整合肿瘤中心的科学家在Cancer Research发表题为“T Cells Promote Metastasis by Regulating Extracellular Matrix Remodeling following Chemotherapy”的研究成果。该团队揭示了CD8+T细胞在化疗诱导下发生“叛变”并协助机体肿瘤发生转移的机制。即在紫杉醇化疗的刺激之下,CD8+T细胞能够通过翻译后修饰增加关键酶LOX的表达水平和酶活性,后者直接促进 ECM重塑并导致肿瘤细胞的播散和转移。

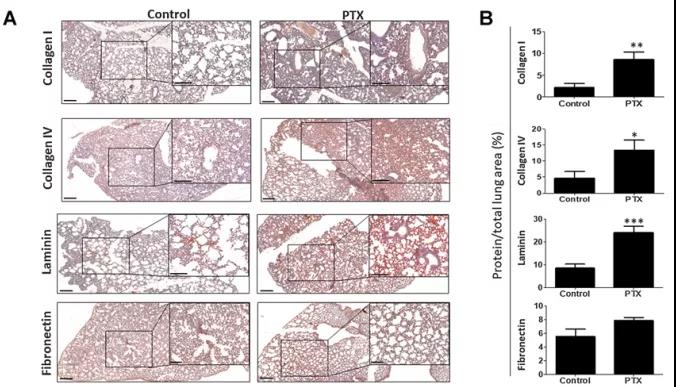
为验证化疗能否引起ECM发生有利于肿瘤转移的变化,以及这种变化是由宿主本身还是肿瘤本身介导,研究人员首先对无瘤小鼠进行紫杉醇(PTX)化疗,并分析肺部ECM成分随时间的变化。借用免疫荧光和免疫组化等多种手段,他们发现在PTX处理后72小时下,肺部的I型胶原、IV型胶原和层粘连蛋白水平显著增加,而肝脏、脾脏ECM以及对照组均未出现类似显著改变。RT-qPCR实验显示,从对照组或PTX处理的小鼠肺中的I型胶原、IV型胶原、层粘连蛋白和纤维连接蛋白的mRNA水平没有显著变化,表明发生的ECM重构并非是由于转录变化,而是与翻译后修饰相关。这些结果说明化疗后ECM结构的快速变化与ECM重构有关,并且这种作用主要是由宿主介导的。
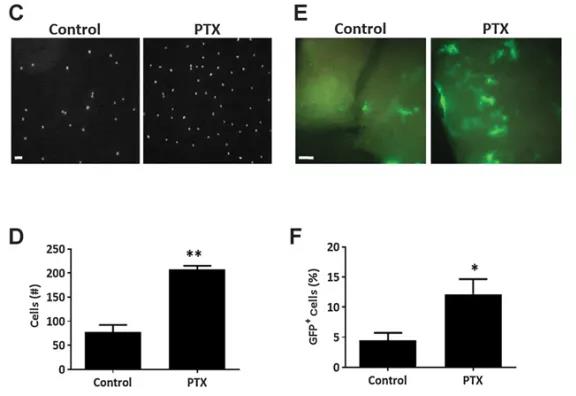
紧接着,该团队试图探究化疗诱导的这种肺部ECM变化对肿瘤定植和转移的影响。在细胞水平发现,PTX处理小鼠的肺组织裂解物处理过的肿瘤细胞黏附能力比对照组更强。体外肺转移试验结果则显示,与对照组相比,PTX处理小鼠的肺切片中所检测到的肿瘤细胞百分比显著增加,而肿瘤大小无显著差异,表明肿瘤细胞的定植能力发生变化,而增殖能力未受影响。在对荷瘤小鼠进行的体内肺转移实验中,也观察到了PTX治疗使肿瘤转移增加的类似作用。综合来看,PTX治疗可诱导肺外基质的快速变化,从而促进肿瘤细胞的播散和转移。
ECM重构的发生依赖于LOX、MMP9和肝素酶等几种细胞外作用的催化酶。在这些酶中,LOX通过催化胶原交联在ECM重构中发挥关键作用。为了确定LOX是否参与化疗诱导的肺组织ECM变化,研究团队评估了其在对照组和PTX治疗小鼠肺中的表达水平和酶活性。结果发现,处理72h时,与对照组小鼠相比,PTX处理小鼠肺部LOX蛋白水平和LOX酶活性显著增加,而处理的4、24和72小时LOX 的mRNA水平并无相应变化。此外,另外两个关键酶-MMP9和肝素酶的表达水平和酶活性分析显示,PTX治疗72小时后其蛋白和mRNA水平及肺组织活性均未见显著变化。表明LOX是参与PTX治疗72小时后ECM重塑的主要酶之一。

为了弄清化疗后肺部LOX水平和活性的增加是全身调控还是非局部效应的结果,研究人员用PTX处理无瘤小鼠72小时后血液作为处理因素,观察接受该血浆72小时后正常小鼠的肺组织变化。数据显示,与注射了对照组小鼠血浆的小鼠相比,实验组小鼠肺组织的I型胶原、IV型胶原和LOX水平显著增加。细胞黏附实验也证实了这些效应,表明LOX水平提示PTX处理是通过诱导全身作用,促进肺ECM快速重塑并促进肿瘤细胞黏附活性。
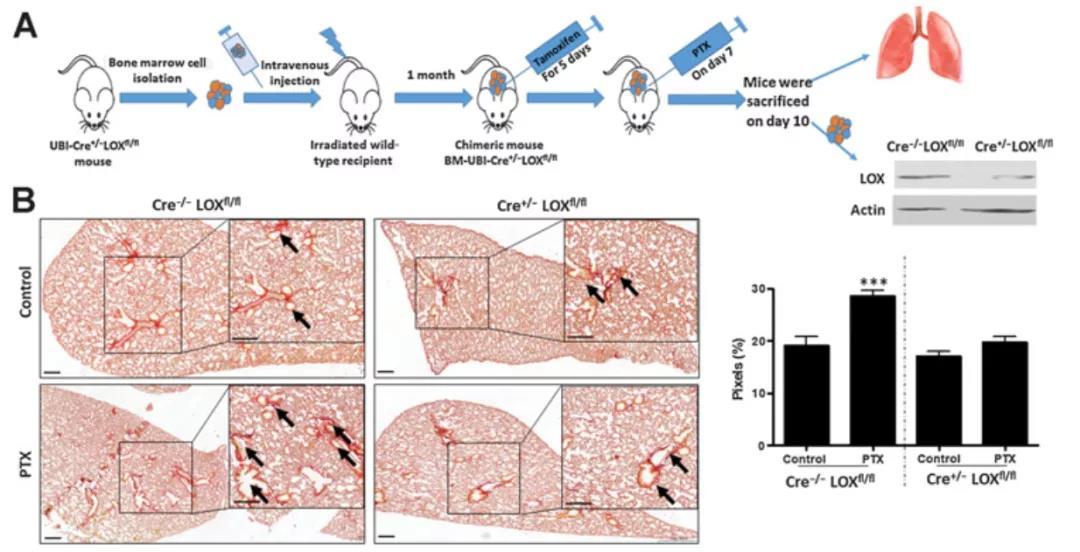
但是增高的LOX从何而来?基于以上发现,研究人员猜想我们假设LOX是由血液循环中的免疫细胞表达的。为了验证这一点,研究人员巧妙地构建了骨髓LOX缺陷嵌合小鼠(记为“BM-LOX-dep”),可实现对骨髓来源细胞的LOX基因表达的关闭。结果显示,与对照小鼠相比,PTX治疗对BM-LOX-dep小鼠肺中的胶原水平没有影响,这一发现提示骨髓来源细胞的LOX才是是PTX诱导ECM重塑的关键。在将范围缩小后,研究团队将关注点锁定在B淋巴细胞和T淋巴细胞。利用B、T淋巴细胞缺陷的SCID小鼠模型重复上述实验,发现与骨髓LOX缺陷的小鼠类似,SCID小鼠的ECM不受PTX处理的影响。这些数据证实了研究人员的猜想,即LOX表达与活性的增加来源于B细胞或T细胞。
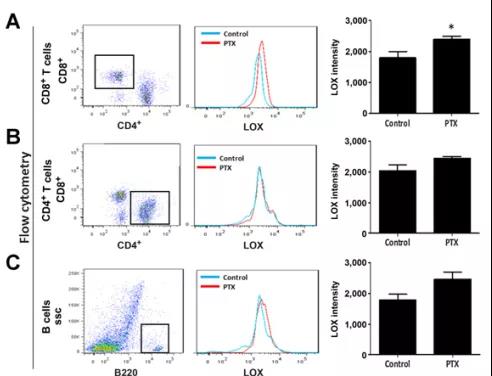
循着这一发现,研究人员对血液、脾脏、肺的B细胞、CD4+T细胞和CD8+T细胞亚群进行比较,发现与对照组小鼠相比,经PTX处理的小鼠仅在肺和脾脏的CD8+T细胞中LOX强度显著增加。外周血中,PTX治疗后CD8+和CD4+T细胞的百分比都增加,但未检测到LOX强度的变化。该团队还将PTX处理后的小鼠的这三类细胞亚群分别注射到SCID小鼠,结果仅注射CD8+T细胞的SCID小鼠能够在PTX的诱导下发生ECM重塑!这些结果均表明CD8+TT细胞是PTX治疗后系统表达LOX和肺部LOX的主要来源之一,即在化疗后向肿瘤“叛变”的细胞。
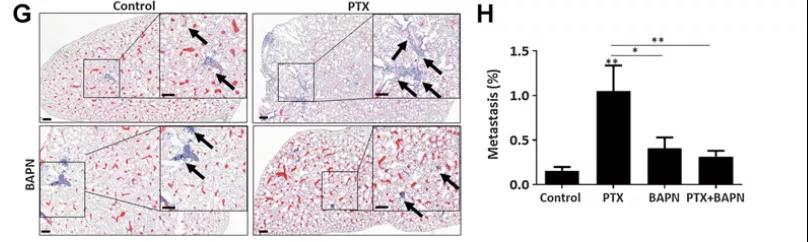
研究人员我们通过乳腺肿瘤小鼠模型来验证阻断LOX是否能逆转化疗诱导ECM重塑与肿瘤细胞黏附的效应。在肿瘤生长达到250mm3大小时,分别给与四组小鼠对照药物、PTX、BAPN(LOX抑制剂)、PTX和BAPN联合治疗。与对照组小鼠相比,单独经PTX处理的小鼠肺部转移灶数量显著增加,而单独经BAPN处理的小鼠没有显示出变化。但与单独使用PTX的小鼠相比,联合使用PTX和BAPN的小鼠肺内转移灶数量显著减少。这一结果有力地证明了LOX抑制可以抵消PTX化疗所诱导的肿瘤转移。
总之,本项研究揭示了化疗诱导肺前转移通过上调T细胞中的LOX来实现ECM重构的机制。在应激条件下之下,肿瘤通过“策反”T细胞,构建利于自身转移的微环境,加速播散和转移,显示出其复杂的生存机制。LOX抑制剂能够靶向抑制这种转移,其与化疗药物的联用或可一定程度克服肿瘤治疗过程中出现的转移,但仍需更多的研究进一步证实。



