作为第三代基因编辑技术的代表,CRISPR/Cas9系统已经凭借其成本低廉、简便易用成为生物医学领域内的高效工具,一度被科研人员称为“瑞士军刀“。目前,CRISPR/Cas9系统已广泛应用于细胞基因编辑、基因调节、基因敲除动物模型的构建、人类疾病动物模型的治疗研究等领域。
然而,随着研究的深入,这把“瑞士军刀“的另一面逐渐显现。研究发现,CRISPR具有重大的潜在风险,包括脱靶效应、染色体改变和潜在免疫原性,以及在基于CRISPR-Cas9的基因敲除(CRISPR-KO)过程中诱发的双链断裂(DSBs)可以导致DNA损伤反应。
近期,美国癌症研究所、Sanford Burnham Prebys医学研究所联合马里兰大学的研究人员共同发表了题为:A systematic genome-wide mapping of oncogenic mutation selectionduring CRISPR-Cas9 genome editing的研究论文。研究团队发现,CRISPR-Cas9基因治疗需要谨慎监测癌症相关基因突变。

CRISPR-Cas9基因编辑技术的工作原理是由内切酶靶向位点切割生物基因组使DNA双链断裂。DSB在细胞内的修复方式为同源重组和非同源末端连接。其中,非同源末端连接的修复机制主要发生于真核生物,通过核苷酸的插入或缺失,不需要同源序列即可重新连接DNA游离末端,进而实现基因敲除的目的。当同源序列存在时,DSB区间大概率发生同源重组,进而定点敲入或编辑基因。
p53是细胞生长周期中的负调节因子,对细胞生长周期调控发挥重要作用。DNA双链一断裂就会被p53基因识别,它在识别到DNA双链断裂后,会阻止细胞分裂。研究团队分析了近1000个人类细胞系对DNA双链断裂的p53反应。研究人员发现,在几乎所有的细胞类型中,进行CRISPR-Cas9基因敲除后,正常的p53基因细胞生长较慢,而出现p53基因突变的细胞受影响较小,它们的生长速度更快,甚至超过正常细胞。值得注意的是,p53基因突变的细胞通常是一些癌细胞。
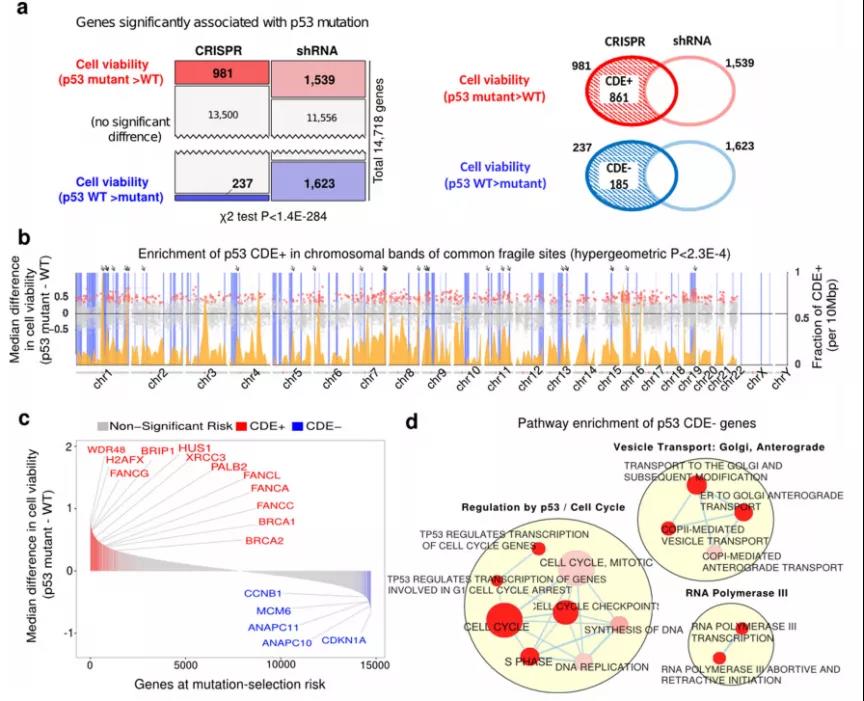
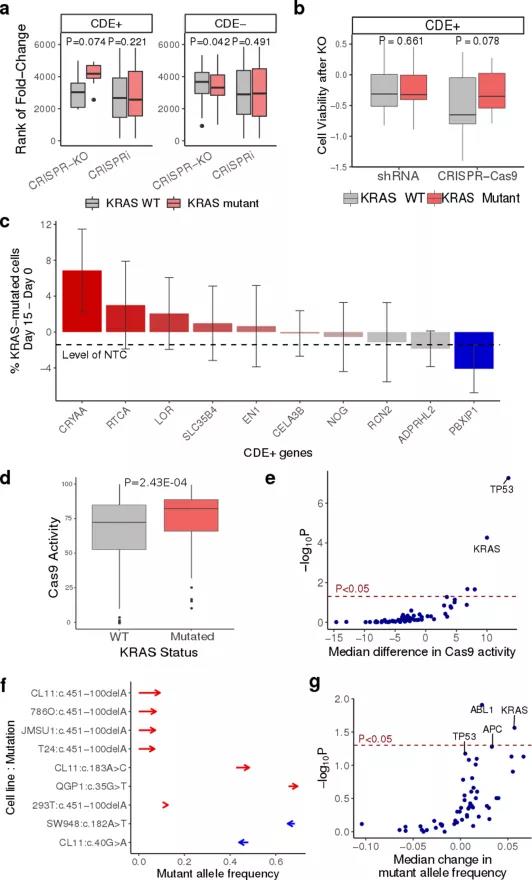
此外,研究人员还发现,CRISPR基因编辑可能会给具有其他癌症相关基因突变的细胞带来优势,比如KRAS致癌基因。
此前研究已经发现,脱靶效应是CRISPR/Cas9基因治疗的明显缺陷,上述研究提示我们,脱靶效应之后需要重点警惕,无关的细胞吸收了CRISPR/Cas9反而有“大麻烦“。要想解决潜在致癌性这个问题,或许要先解决基因编辑技术面临的核心难题脱靶效应。能够找到理想的靶向输送系统,精准地将CRISPR/Cas9运送到人体靶细胞内,潜在致癌风险也就不是大问题了。
脱靶效应、染色体改变和潜在免疫原性背后的作用机制还需要更多深入研究加以佐证。总的来说,上述研究结果表明,使用CRISPR-Cas9时,要重点监测癌症相关基因突变,特别是p53基因和KRAS基因。



