结肠癌是一种发生于人体结肠部位的消化道恶性肿瘤,多发于40-50岁。随着社会的发展,人们的生活习惯逐渐受多种外来文化的影响发生了巨大的变化,偏好重口味、高糖高脂饮食、饥饱失常、饮食不洁、熬夜,使结肠癌的发病日趋于年轻化。
近日, 学术期刊《Nature》三连发表重磅文章拆穿了癌细胞的“把戏”,为结肠癌高危人群提供了新的预防策略。同时,《Nature》还在线发表题为Cancer stem cells in the gut have a bad influence on neighbouringcells的 News & Views,提供了有关癌细胞及其邻近细胞在肠道中的竞争动态的重要见解。

众所周知,干细胞是一类具有无限的或者永生的自我更新能力的细胞、能够产生至少一种类型的、高度分化的子代细胞,如果不把体内的癌症干细胞彻底清除,发生突变的肠道干细胞就会“策反”周围健康细胞,抑制周围健康的肠道干细胞活性,使癌症复发和转移。
而干细胞中的腺瘤性结肠息肉(APC)病基因作为结直肠癌抑癌基因,是胚系和体突变较常发生部位。当该基因发生突变时,会诱导b-catenin的磷酸化和降解,负调控WNT途径,诱发结肠癌。为此,科学家们一直致力于将癌症干细胞斩草除根。
近年来,随着深度靶向 DNA 测序等技术的推进,研究人员注意到人体正常组织中早已潜伏了与癌症相关的突变基因。因此,为了探明促癌突变细胞与正常的邻近细胞之间的相互作用,剑桥干细胞研究所的科研人员开发了一种显微技术,使用多色标记技术来追踪单个突变基因Kras和Pik3ca的轨迹,研究发现,突变的癌症干细胞竟能分泌特定的细胞因子,抑制周围健康的肠道干细胞活性。

当然,研究人员的科研进程并未止步于此。英国癌症研究中心的科研人员建立了一个体外细胞培养系统,使单个细胞在体外环境发育成“小肠类器官”结构,以评估干细胞的活力。
令人振奋的是,试验发现了引起Apc突变的关键媒介"NOTUM基因",与正常细胞相比,该基因在Apc突变细胞谱系中表现出更高的表达量,可作为预防Apc突变型结直肠癌的靶点,并可通过遗传或药物方式抑制NOTUM,从而抑制Apc突变细胞的扩张和肠道腺瘤的形成。

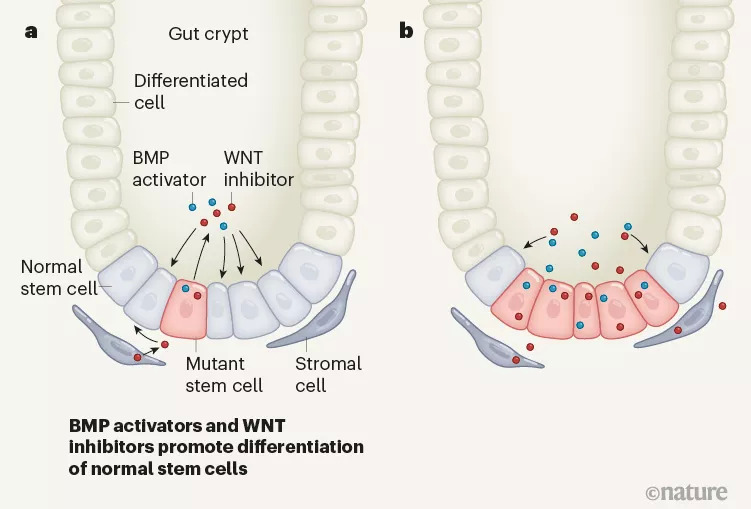
为了深入研究正常和恶性干细胞之间相互作用的机制,荷兰阿姆斯特丹大学医学中心的研究者们通过构建Apc基因失活介导的小鼠和人类肠癌模型,发现APC介导的b-catenin是一种有助于维持肠道干细胞状态的基因表达调节剂,会积极抑制邻近细胞的生长甚至诱导野生型肠道干细胞凋亡。
不仅如此,携带Apc突变的癌症干细胞相比于正常干细胞时有更强的竞争优势,这种优势是由于Apc突变细胞能分泌WNT拮抗因子,不仅抑制了正常干细胞的活性,还会促进其分化。而研究发现,氯化锂能消除WNT拮抗因子的抑制作用,为预防肠癌提供了新的策略。

迄今为止,医学界在癌症领域的研究重点一直放在促进免疫系统介导的防御上。然而,如今干细胞和组织环境对肿瘤的重要性也慢慢被挖掘,在未来的进一步研究中,如果能够在Apc基因突变的小鼠模型中使WNT信号通路重启、并限制NOTUM的功能,就有望抑制肿瘤的发生与发展。
总而言之,这三项突破性研究给今后的癌症治疗提供了新的思路,可以通过抑制恶性肿瘤干细胞的分化作用来消除癌症的竞争优势,未来,期待科学家能针对这一特性开发全新的抗癌疗法。



