众所周知,CAR-T细胞疗法对于血液癌可谓是一种重磅杀伤武器,但是却在实体瘤领域并未显现巨大威力,其原因之一便是缺乏肿瘤特异性靶点。
不过,针对实体瘤的CAR-T疗法正在一步一步实现突破,近日,美国费城儿童医院的研究人员开发了一种新型癌症疗法,他们以神经母细胞瘤为研究对象,识别出了存在于肿瘤细胞表面的肽,并且可以用“以肽为中心”的嵌合抗原受体( “peptide-centric” chimeric antigen receptors,PC-CAR)进行靶向,这种新型的CAR-T细胞能够刺激免疫反应,并在小鼠体内进行测试后,显示出了肿瘤消退的治疗效果。该研究以“Cross-HLA targeting of intracellular oncoproteins withpeptide-centric CARs”为题目发表在了期刊《Nature》上。

在实体瘤癌症中,大多数负责肿瘤生长和存活的蛋白质位于肿瘤细胞的细胞核,而不是在细胞表面。如果在细胞表面,它们通常可以被CAR-T细胞直接识别与杀伤。不过,这些蛋白质的片段也有可能通过主要组织相容性复合体 (MHC)上的肽呈递到肿瘤细胞表面,如果这些肽是突变肽,它们将会被免疫系统识别为异体组织并被杀死,这便是研究人员开发PC-CAR疗法来治疗实体瘤的初衷之一。
神经母细胞瘤是一种具有侵袭性的儿科癌症,它是由促进不受控制的肿瘤生长的基因表达修饰所驱动的。目前,神经母细胞瘤患者在接受化疗、手术和放疗后,经常会因耐药问题而导致疾病复发。这种肿瘤的突变负荷和MHC蛋白表达较低,使得免疫疗法难以靶向,因此便成为了解决阻碍癌症免疫疗法广泛发展问题的理想模型。
在此次研究中,研究人员假设神经母细胞瘤细胞表面的一些肽来自对肿瘤生长和存活必不可少的蛋白质,并可以用合成的CAR进行靶向,这些PC-CAR T细胞将能够直接靶向和杀死肿瘤细胞。这一新疗法的挑战在于,如何将肿瘤特异性肽与其他外观相似的肽或存在于正常组织中的肽区分开来,以避免交叉反应和致命毒性。
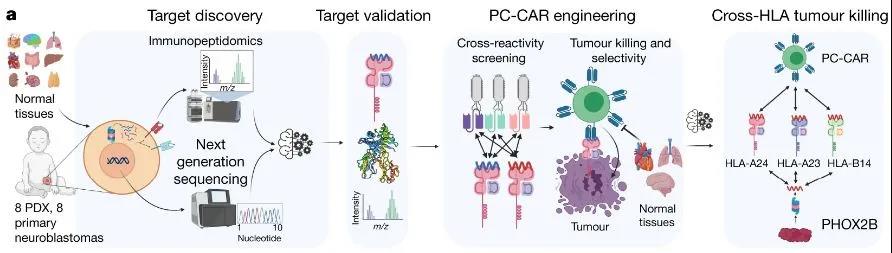
首先,研究人员进行了肿瘤特异性抗原的鉴定,他们从神经母细胞瘤细胞上剥离了MHC分子,并确定存在哪些肽以及丰度如何。为了清除任何可能与正常组织有交叉反应的潜在抗原,研究人员根据正常组织上的MHC肽数据库过滤了剩余的肽,去除了在正常组织中具有亲本基因的肽。使用这种多组学方法,研究人员确定了一种未突变的神经母细胞瘤肽,它源自PHOX2B,是一种神经母细胞瘤依赖性基因和转录调节因子。
在确定了可靶向的抗原PHOX2B后,研究人员便开始进行PC-CAR的开发,并对其疗效进行了试验与检测。结果表明,PC-CAR T细胞可识别不同HLA(人类HMC)类型的肿瘤特异性肽,这意味着该治疗可应用于不同遗传谱系的患者。
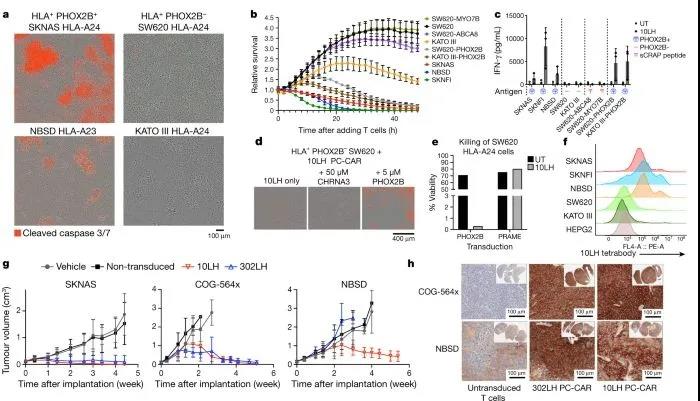
随后,研究团队在小鼠体内中测试了PC-CAR疗法,结果显示该疗法诱导了肿瘤中MHC的大量上调,同时,用于治疗的小鼠在使用该疗法一周后,神经母细胞瘤肿瘤消退,这表明,这一疗法可以在低抗原密度下激活T细胞以启动前馈级联反应,从而增加 MHC 和抗原呈递,显示出疗效。
研究人员表示:“我们对这项研究感到兴奋,因为它让我们现在能够追踪过去被认为是‘无法成药’的重要癌症驱动因素。我们认为PC-CARS有极大潜力扩大免疫疗法的范围,并显著扩大符合条件的患者群体,”此次的研究可谓是CAR-T疗法在实体瘤领域的重大突破,也让我们期待更多的科研进展,以惠及更多患者。



