癌症疫苗是近年来的研究热门之一,且宫颈癌疫苗已经问世,这无疑给其他癌症疫苗研发带来了无限希望。
2021年11月,《Naturebiomedical Engineering》发表了题为“Cancer vaccines from cryogenicallysilicified tumour cells functionalized with pathogenassociated molecularpatterns”的研究论文,展示了通过肿瘤细胞的低温硅化来制造癌症疫苗的技术。硅化的癌细胞可以模拟病原体的细胞激活树突状细胞,并促进肿瘤抗原的吞噬、加工和呈递T细胞,并增强免疫反应,有益于抑制癌细胞的生长。

在以往的研究中发现,癌症可以引发肿瘤特异性免疫反应,这也是癌症疫苗研发的可行性证据。理论上,所有的癌症都是可以进行免疫治疗的,然而在寻找癌症的抗原时,研究人员遇到了很多困难。因为每种癌都有各自的特性,即使搞清楚了特性并且经历千辛万苦提取后,经常又会出现提取的抗原并不是特异性的,无法起到免疫作用。
在本研究中,研究者们利用病原体分子模式功能化修饰低温硅化的肿瘤细胞,开发出了一种高效制备癌症疫苗的方法。以单细胞硅藻为灵感,研究者们改进了生物硅化过程,通过低温硅化保存了个体患者的癌症特异性抗原。硅化材料表面的羟基化硅可以修饰病原体分子模式(PAMPs)以增强细胞免疫原性并指导下游免疫反应,有利于治疗效果。这是因为树突细胞表面的TLR蛋白可以识别PAMPs并激活免疫过程。例如,TLR-4识别来自革兰氏阴性细菌的脂多糖(LPS)或其衍生物单磷酸基脂质A (MPL),而TLR-9识别细菌低甲基化CpG DNA基元。
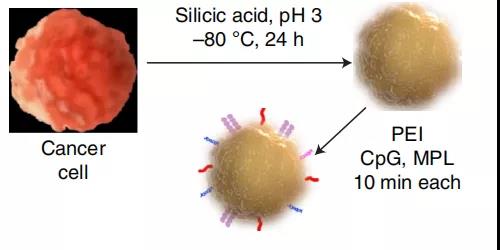
硅化癌细胞表面修饰CpG和MPL可以增强树突细胞摄取和激活。共聚焦显微镜和流式细胞术证实:同活的或固定的肿瘤细胞相比,与CpG和MPL结合的硅化肿瘤细胞的树突细胞摄取增加了9倍。
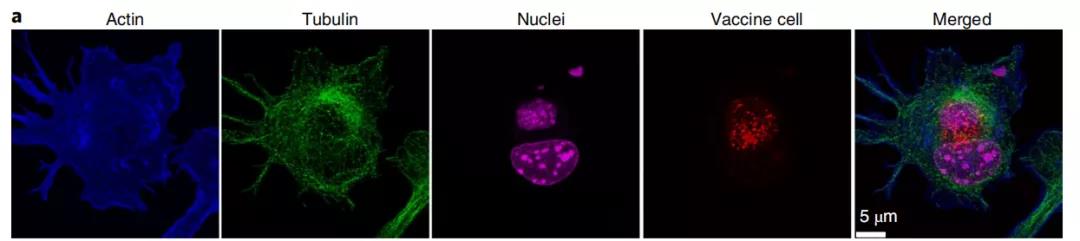
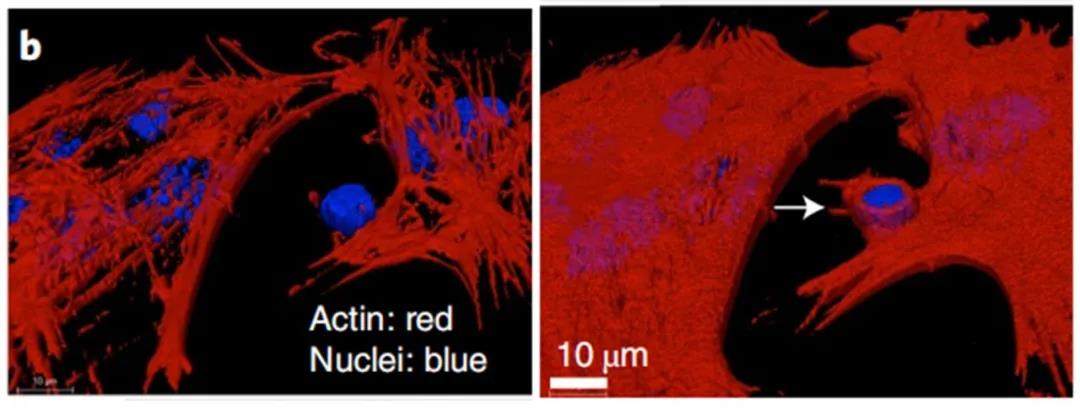
在以上体外实验中,由于PAMPs修饰的硅化癌细胞表现出优异的性质(增强树突细胞摄取和激活免疫过程),研究者们将PAMPs修饰的硅化癌细胞作为癌症疫苗(Si疫苗)进行了体内试验。在小鼠体内(卵巢癌模型),Si疫苗同样能够产生肿瘤特异性免疫。研究者们把疫苗注射给实验小鼠,三周后再注射活的肿瘤细胞,结果显示:与对照组(PBS和单独的Si细胞处理)相比,Si疫苗细胞治疗的小鼠显示出全部的肿瘤移植阻断。
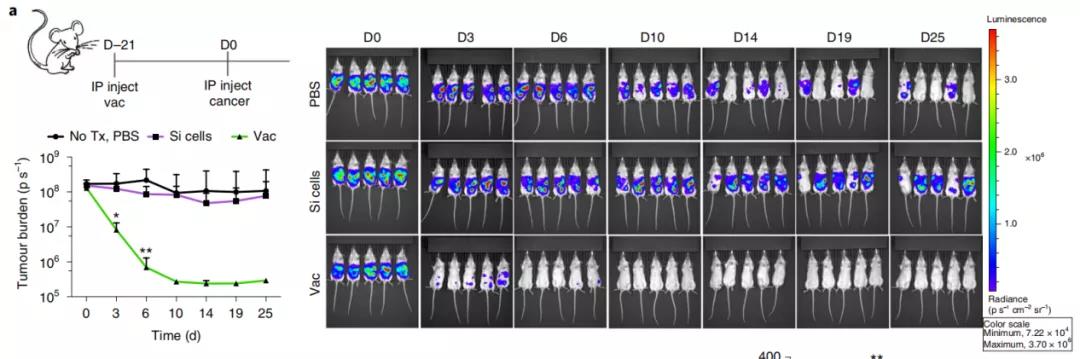
不仅如此,Si疫苗还有清除已有肿瘤的能力。Si疫苗与直接辐射处理(IR)和辐射癌细胞制备的的临床疫苗(IR-vac)相比, Si疫苗组全部消除了小鼠的腹膜肿瘤,明显优于IR和IR-vac组。Si疫苗还可以增强肿瘤相关淋巴细胞的免疫功能以及对化疗的协同作用。此外si疫苗可以在室温下脱水和储存,在重溶时,表面结合功能基团可以根据患者进行量身定制。
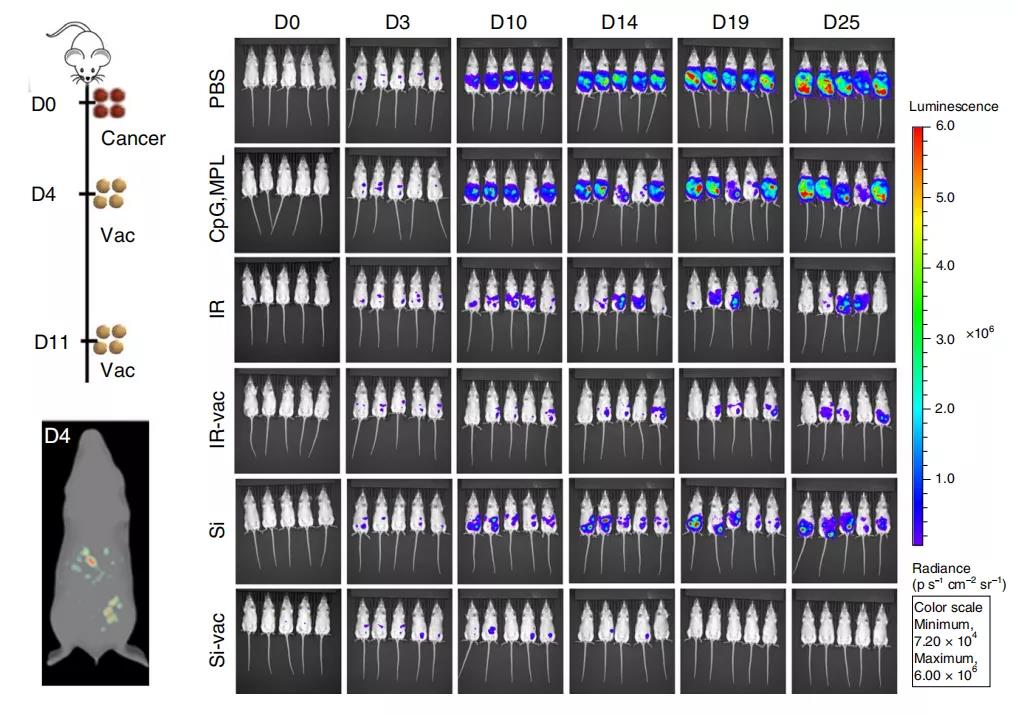
总而言之,研究者们创新性地提出了一种癌症疫苗的制备方法,并在体内和体外试验中证明了这种癌症疫苗的可行性。与现有的癌症疫苗制备方法相比,这种策略具有更多样的功能和优势,比如保持肿瘤抗原的活性和调节免疫反应的能力。值得注意的是,Si疫苗可以在室温下脱水和储存过程保持性能,这将大大降低癌症疫苗的生产和销售过程的储存条件,促进癌症免疫治疗的发展,这将是治疗癌症方面的一场历史性的变革!



