众所周知,在血液循环中,红细胞主要负责向身体各个器官和组织输送氧气,好像一个安静低调的搬运工。然而,近期的研究发现红细胞比我们想象的要重要得多。
美国宾夕法尼亚大学研究团队在《Science Translational Medicine》发表论文:“DNA binding to TLR9 expressed by red bloodcells promotes innate immune activation and anemia”,揭开了红细胞的“新身份”。
研究发现,红细胞(red blood cells,RBC)不仅仅是氧气搬运工,还承担着侦察兵的角色,它是免疫系统中的重要一环,其膜表面可以表达TLR9蛋白,并能够在体外与细菌、疟原虫和线粒体的 CpG-DNA 结合,加速红细胞吞噬作用和先天免疫激活,促进炎症细胞因子分泌、免疫细胞成熟和增殖,从而在病理状态下起到免疫哨兵的作用,这一发现揭示了红细胞作为氧气运输功能关键参与者之外未被重视的另一功能。
在呼吸系统中,红细胞接受来自肺部的氧气运动到身体的各个组织,这也让它有更大的几率接触到病原体或者抗原。研究人员在脓毒症患者与新冠肺炎患者的血液中对红细胞进行了研究,结果发现,在脓毒症期间,红细胞表面TLR9增加,同时,表达TLR9的红细胞可以结合内线粒体的CPG-DNA。在炎症状态下,这种现象可以加速身体的免疫进程。
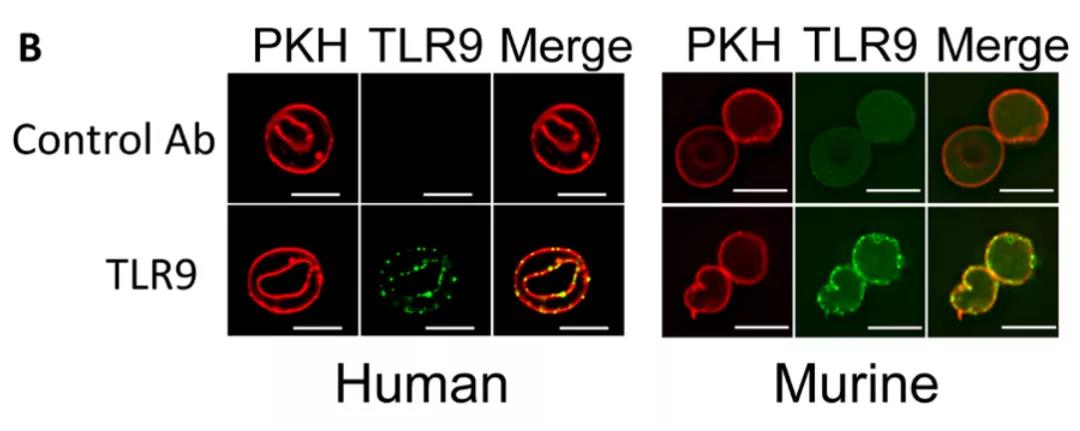
那么,TLR9红细胞与CPG-DNA的结合,是否会使红细胞的结构与功能产生变化呢?研究显示,在无菌炎症和感染期间,血浆中含有CPG的游离DNA升高,研究者们用CpG-DNA直接处理红细胞,并用电子显微镜直接观察到了红细胞外形结构的变化:与CPG结合的红细胞明显发生了变形,细胞膜发生皱缩。为进行进一步确认,研究人员采用流式细胞术检查了CpG红细胞孵育后的形态,该分析显示,与 CpG 结合的红细胞确实具有异常形态。
除了形态,红细胞的功能也发生了一定变化,研究人员采用逐量添加CpG-DNA的方式,观察其对红细胞功能的影响,分析结果显示,CpG-DNA的添加导致红细胞的渗透脆性降低,而渗透脆性降低的红细胞,将极易诱发炎症病人贫血的发生 。

随后,研究人员发现,与CpG结合的红细胞会导致CD47蛋白的缺失,而CD47蛋白的缺失会加速红髓 F4/80 阳性脾巨噬细胞 (RPM)的吞噬作用。当红细胞结合CpG-DNA之后,将导致免疫系统通过巨噬细胞加速清除体内的坏死细胞、病原体等以保护机体不受伤害。当研究人员用PBS(空白组)和CpG DNA(实验组)处理红细胞2小时,并将其注入小鼠体内,他们发现输注1小时后小鼠体内的巨噬细胞开始摄入红细胞。与空白组相比,实验组显示更多的红细胞被巨噬细胞吞噬,20小时后脾脏更加严重,这一现象与红细胞吞噬增多导致的脾充血的现象吻合。而这些发现表明,红细胞结合CpG-DNA导致体内红细胞被吞噬的进程加速,巨噬细胞清除结合CPG-DNA的红细胞将激活机体的先天免疫。
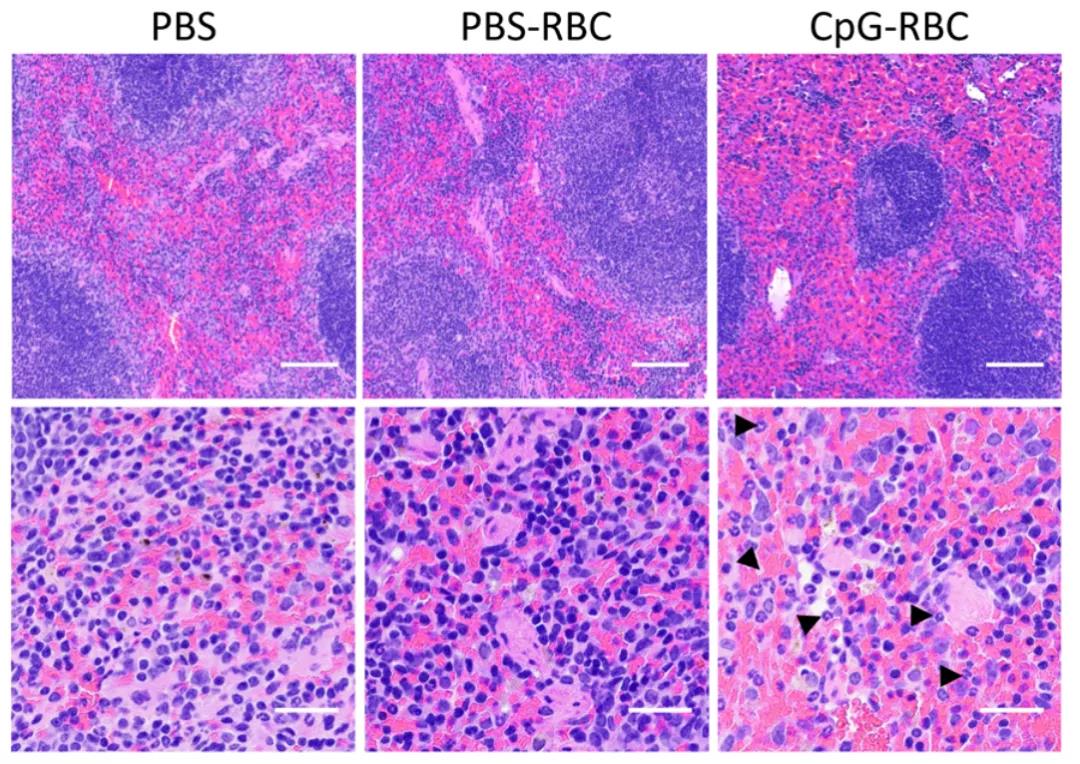
总之,在这项研究中,研究者们确定了红细胞在免疫应答感染中的新作用。多种感染性和非感染性炎症性疾病的贫血发病机制可能就是因为血浆中过量的CpG-DNA导致红细胞的清除和破坏,从而导致炎症患者产生了严重的贫血病症。而这项研究成果与先前发现的血小板在先天和适应性免疫中的作用相结合,可以真正的了解血管腔内的先天免疫,具有巨大的疫苗开发和免疫治疗方法的潜力。



