阿尔茨海默病(AD)俗称老年痴呆症,是一种神经退行性疾病,是一种与淀粉样蛋白原纤维(Aβ)沉积和神经纤维缠结(NFTs)密切相关的线粒体功能障碍。治疗AD的药物一直在开发,但是效果都很有限,主要原因是:对认知功能的影响较差或有显著的副作用以及血脑屏障穿透性较弱,难以达到理想的治疗效果。
在以往的研究中发现,氧化应激是AD早期神经元中一种常见的生理变异,并且与Aβ和NFTs的形成关系密切。简单来说,Aβ与细胞内活性氧是协同递增的关系,可以进一步提高细胞内活性氧ROS产量,改变线粒体膜电位,破坏Ca2+稳态,NFTs则可以导致线粒体功能障碍。这两种病理因素以正反馈的方式相互作用,并导致神经元内源性凋亡,造成阿尔兹海默症的发生。此外,细胞内活性氧ROS还可以诱导神经炎症,因此,细胞内活性氧ROS被认为是AD早期的关键因素。基于以上可知,细胞内消除ROS可以防止神经退行性变异,即缓解阿尔茨海默病的症状。
2021年10月,来自暨南大学的研究团队在《ACS APPLIED MATERIALS&INTERFACES》发表了论文A Functionalized Octahedral Palladium Nanozyme as a Radical Scavenger forAmeliorating Alzheimers Disease。在这项研究中,研究者们设计并制备了八面体钯(Pd)纳米酶复合材料(Pd@PEG@ Bor)将中药成分冰片(Bor)偶联在Pd@PEG纳米材料的表面用于提高穿过血脑屏障和靶向神经元的效率。
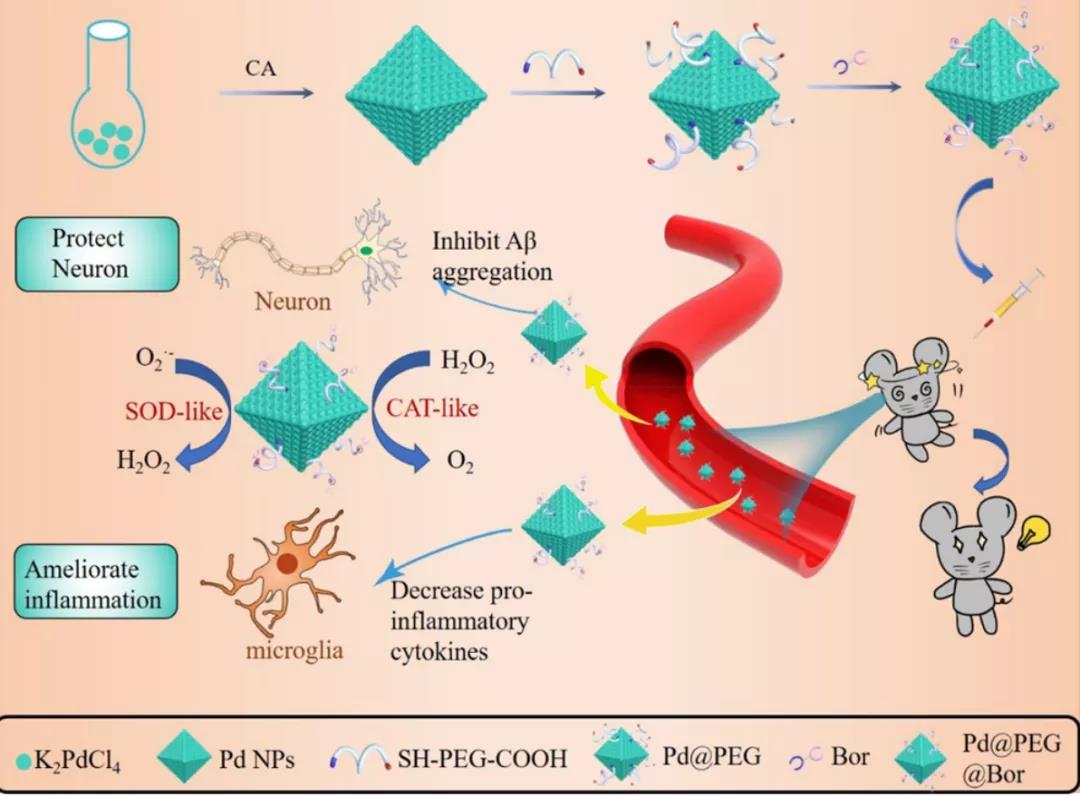
研究者们分别从抗氧化、生物相容性、消除ROS、血脑屏障透过实验、小鼠行为学等方面表征了复合材料的生物学性能,证明了这种复合材料能提高穿过血脑屏障的效率以及靶向神经元,消除细胞内过多的ROS,维持线粒体膜电位和钙离子水平,抑制Aβ的产生和聚集,减少神经炎症,保护神经元,并进一步改善AD小鼠的认知障碍,可以有效缓解AD的症状。
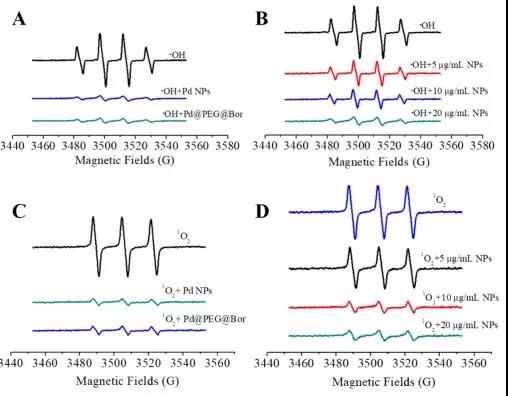
(1)抗氧化活性实验。实验结果表明:单独的Pd纳米颗粒(Pd NPs)和复合材料(Pd@PEG@Bor)对羟基自由基和单线态活性氧都具有很强的清除能力,浓度越高清除能力越强。冰片(BOR)和PEG对Pd NPs的修饰不影响抗氧化能力,因此,可以通过修饰功能基团来改善复合材料的功能,这也本研究的基础原理之一。
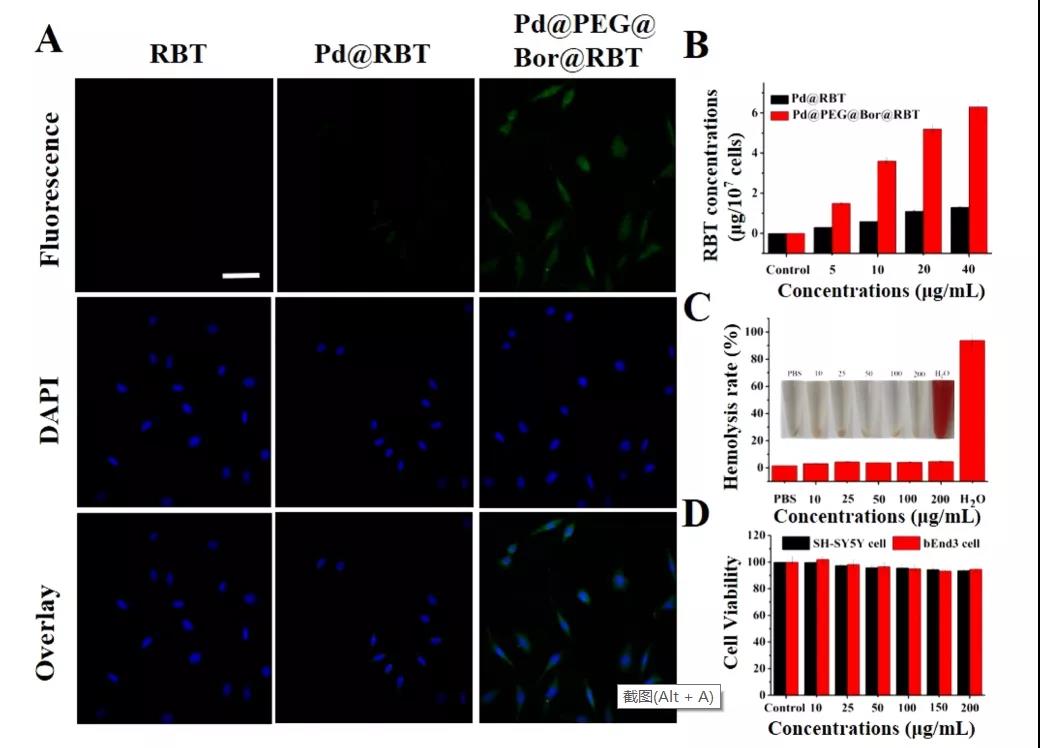
(2)生物相容性实验。纳米材料良好的生物相容性是临床应用的前提。实验数据表明:Pd@PEG@Bor对正常生物膜是无伤的。采用CCK-8法,用复合材料处理细胞24 h后,细胞活力持续大于90%,处理72 h后,大部分细胞仍然存活,表现出良好的生物相容性。更重要的是,研究者们用复合材料尾静脉注射24 h后,小鼠大脑(丘脑、海马和皮层)和主要器官(心、肝、脾、肺和肾)均未发现损伤。总之,体外和体内实验表明复合材料都具有良好的生物相容性和弱的细胞毒性。
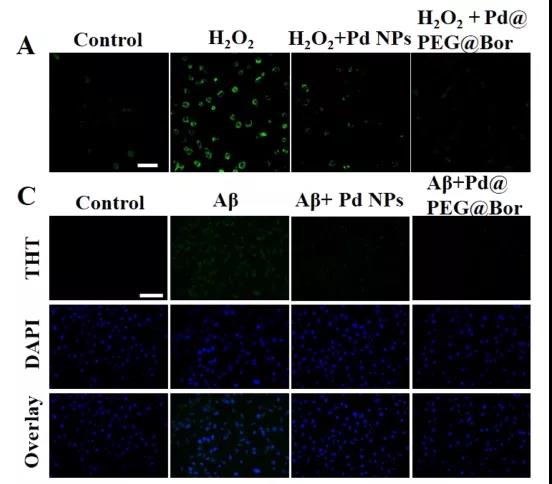
(3)Pd@PEG@Bor消除活性氧并使体外Aβ含量下降。在研究中,研究人员通过染色,用荧光强度表示活性氧的含量,采用ThT染色法检测Aβ聚集物。在实验中,在空白样品中加入双氧水后,细胞的活性氧显著增多,再加入Pd@PEG或者Pd@PEG@Bor后,细胞的活性氧显著减少,说明他们是出色的ROS清除剂。加入Pd@PEG和Pd@PEG@Bor处理24 h后,细胞的ThT的荧光强度显著下降,说明Pd@PEG和Pd@PEG@Bor可以通过缓解氧化应激来减少Aβ的生成和沉积。
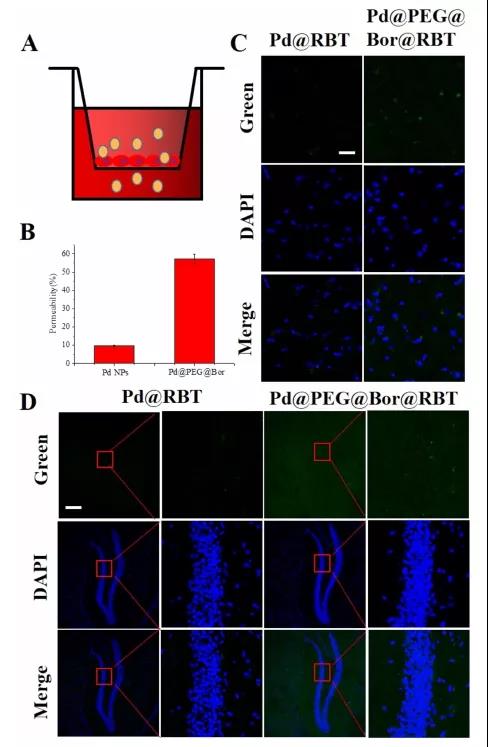
(4)Pd@PEG@Bor在体外和体内穿越血脑屏障的能力。研究人员以RBT为探针,利用激光共聚焦显微镜比较Pd NPs和Pd@PEG@Bor在小鼠顶叶皮层和海马中的分布。发现Pd@PEG@Bor处理的小鼠的顶叶皮层和海马中的荧光强度高且主要集中在胞质中。Pd@PEG@Bor的渗透率是Pd NPs的5.5倍。总之,此实验证实Bor可以促进血脑屏障的有效穿透。
(5)AD小鼠的行为实验。AD小鼠在实验中反映出显著的焦虑抑郁行为。然而,静脉注射Pd@PEG@Bor后,焦虑抑郁行为得到改善。在其他行为实验中分别证明了Pd@PEG@Bor治疗后可以提高AD小鼠的研究能力和记忆能力。总之,小鼠的行为学实验表明复合材料能有效减轻AD小鼠的认知缺陷。
总结:研究者们合成了一种新型纳米复合材料Pd@ PEG@Bor,可用于改善阿尔兹海默症,降低Aβ水平,改善神经炎症,提高学习和记忆能力,为攻克这个棘手的疾病找到了一丝曙光!



