2020 年初,新冠疫情肆虐全球,各国药企均大力投入疫苗研发,希望及时研发出有效疫苗以阻止疫情扩散,这也让原本还远离大众视线的 RNA 疗法,广为人知。
相比于传统疫苗,RNA 疫苗仿佛是专门为新冠疫情准备的。美国疫苗生产企业 Moderna 在得到新冠病毒基因组序列后,仅用了 4 天,就获得了新冠病毒刺突蛋白编码片段,并合成相应 RNA,随后将其封装便可作为新冠疫苗。
RNA 疫苗被递送至人体后,可在人体细胞内源源不断的产生病毒蛋白,相当于将机体转化为“疫苗工厂”,训练免疫系统识别病毒入侵。然而,由于缺乏稳定、强大的 RNA 递送平台,RNA 疫苗的使用始终受限。
现在,RNA 疫苗使用的局限性有望被打破。
来自麻省理工学院的华人科学家张锋教授带领的研究团队,成功开发了一种全新RNA递送平台——SEND。SEND 以人体内天然存在的 RNA 运输蛋白 PEG 10 为基础,通过对 PEG 10 蛋白进行改造就可以将不同的 RNA 运送到不同的细胞或器官。由于是天然存在于人体中的蛋白质,该平台相较于其他 RNA 递送方法可以有效避免机体的免疫攻击。
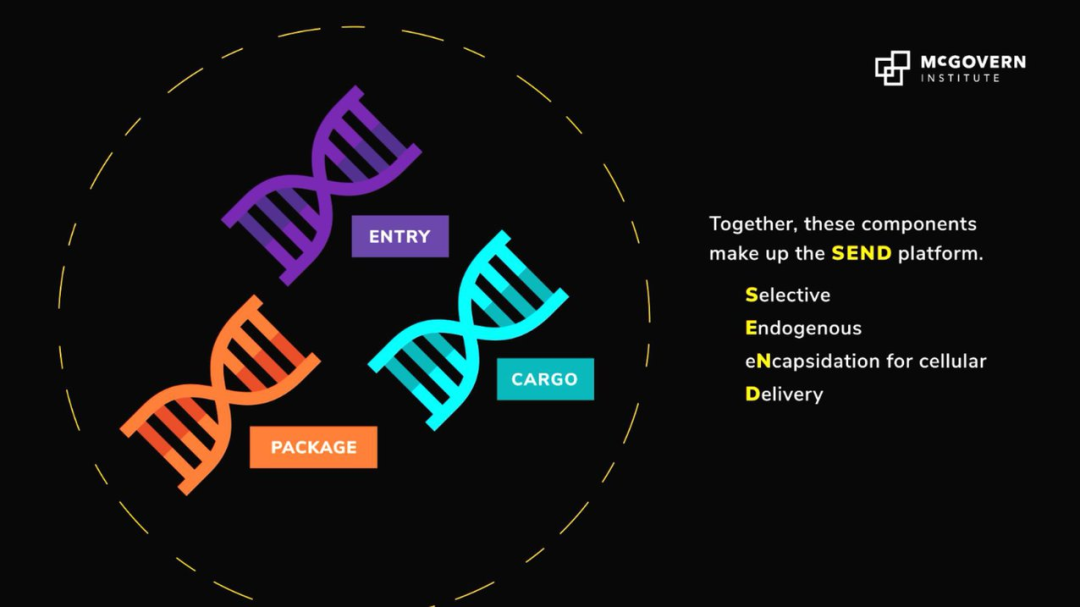
图 | 全新的 RNA 递送平台 SEND(来源:MIT)
该研究以“Mammalian retrovirus-like protein PEG10 packages its own mRNA and can be pseudotyped for mRNA delivery”为题,发表在 Science 杂志上。
(来源:Science)
对于这一研究结果,CRISPR基因编辑技术的先驱者、Broad研究所核心研究成员、McGovern研究所研究员张锋表示,“生物医学界一直在开发强大的分子疗法,但是如何将它们精确有效的传递给靶细胞,仍旧具有挑战性。而 SEND 有望克服这些潜在的挑战。”
一切蛋白质层面的疾病,都可以使用 RNA 疗法解决
目前上市的小分子药物,绝大部分的靶标都是蛋白质,这一策略在过去数十年来也带来了大量好药和新药,据估计,接近 99%的口服药物靶向的是致病蛋白。
但新药研发人员对此却并不满足。首先,不少蛋白质无“可成药性”,这意味着很难对其开发具有抑制性的小分子;其次,蛋白只占了基因组信息的极少部分。人类的基因组中,只有 1.5%的序列编码了蛋白质,和疾病相关的蛋白更是只占其中的 10-15%。毫无疑问,如果小分子药物的靶点能超越蛋白质,将给新药研发带来新的变革。

图 | 因新冠疫情,mRNA 疫苗变得广为人知(来源:Pixabay)
RNA 就是这样一种潜在的靶点。在正常细胞中,RNA 有着重要的生理功能——mRNA 携带了基因的遗传信息,指导蛋白质的合成;非编码 RNA 则调控基因的表达。
靶向RNA也有着多种好处:由于处于蛋白质的上游,靶向 RNA 有望直接对蛋白质的翻译效率进行上调或下调,解决蛋白“不可成药”的难题;RNA 在人类基因组中极为丰富,产生非编码 RNA 的序列更是占到了基因组的 70%,丰度比编码蛋白质的序列高出一个数量级。
然而在既往的几十年间,由于 RNA 分子容易降解,在体内半衰期很短,一直被认为无法成为“治疗药物”。
直到近年来,随着技术进步以及稳定性化学的改进,半衰期较短的 RNA 分子反而成为了临床新宠,逐渐吸引了业界的注意,进入爆发增长阶段。
作为一种新型疗法,RNA 药物的研发周期短、生产工艺简单、成本低、效果强、产能扩张迅速、安全性更好,这是其天然的优势。例如,疫情期间,新冠病毒 RNA 疫苗的研发在得到病毒基因序列后数天之内就完成了,其疗效也得到了真实世界数据的验证。
目前,RNA 疗法的应用前景十分广阔,包括疫苗、肿瘤免疫治疗、单抗药物替代、蛋白药物替代、辅助生殖等等。理论上,一切蛋白质层面的疾病都可以通过 RNA 疗法治疗。
RNA药物的障碍:递送
虽然 RNA 药物的应用前景非常广阔,但是目前 RNA 药物的研发也面临着一个巨大的挑战,那就是 RNA 递送的问题。
核酸药物想要进入体内,主要有以下3个难关:核酸的分子量和负电荷使其不能自由通过生物膜;RNA 容易被血浆和组织中 RNase 酶降解,被肝脏和肾脏快速清除和被免疫系统识别;进入细胞后 “卡” 在内吞小体中无法发挥功能。
以上几点让 RNA 药物发展面临的技术障碍——药物递送,一直没有得到解决。目前,解决递送问题主要有两个方法:一个是改造核酸分子,让其稳定并躲避免疫系统的识别;另外一个就是利用药物传输系统,比如说脂质纳米颗粒(LNP)和载体病毒。
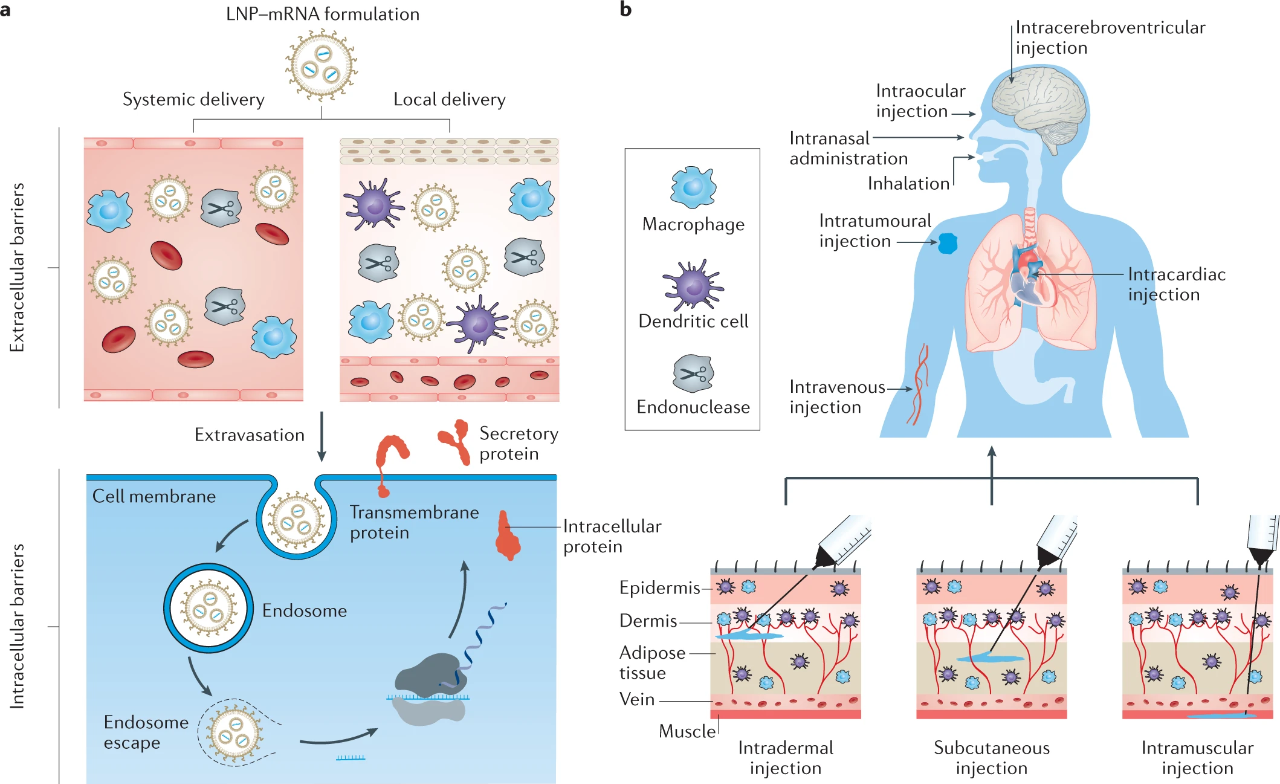
图 | mRNA 药物的脂质纳米颗粒递送途径(来源:Nature)
纳米脂质体递送 RNA 的原理目前还不清楚,但是通常认为,纳米脂质体通过非共价亲和力和细胞膜结合并通过内吞作用被摄取,进入细胞后 RNA 逃离内吞小泡,被释放到细胞质中表达靶蛋白。纳米脂质体还可以通过相反的胞吐作用被排出细胞外,这也是通过纳米脂质体进行 RNA 给药需要注意的点。
目前 RNA 还是主要依靠纳米制剂递送,而由于纳米脂质体的限制,所以目前RNA疗法仅适合肝脏、脾脏靶向治疗,其他组织难以靶向。同时,mRNA 药物过膜性低也导致出现悬殊的个体差异,如果药物过膜性是 1%,那么 1% 的个体差异会导致两倍有效药物浓度差异,但如果过膜性是 50%,那么 1% 的个体差异则无关紧要。
现在业界的策略是,首先选择疫苗这样安全窗口较大的项目,但如果扩大到更复杂靶点,业界需要找到可监测药物应答的生物标记。
打破RNA治疗困境
PEG 10 蛋白天然存在于人体内,源自一种类似病毒的遗传元件——“逆转录转座子”。PEG 10 蛋白在数百万年前被整合进人类祖先的基因组中,随着时间的推移,PEG 10 已与人类基因组融为一体,在人体内发挥重要的功能。
此前,研究人员发现,另一种逆转录转座子衍生蛋白 ARC 可以形成病毒样结构,并参与细胞间 RNA 的转移。这一研究结果表明,逆转录转座子相关蛋白或许可以作为 RNA 递送平台用于 RNA 疗法,但是此前科学家尚未成功利用 ARC 蛋白在哺乳动物细胞中运送 RNA。
为了进一步探索逆转录转座子蛋白的功能,张锋教授带领研究团队对人类基因组中的逆转录转座子蛋白进行了系统的搜索,寻找潜在可以运输 RNA 的蛋白质。
初步分析显示,人类基因组中有 48 个基因可能编码了逆转录转座子蛋白。其中,有 19 中蛋白质同时存在于小鼠和人类中。
在体外研究中,研究人员发现,逆转录转座子蛋白 PEG 10 是一种高效的 RNA 载体蛋白。相比于其他逆转录转座子蛋白,PEG 10 在哺乳动物细胞内穿透性更强,且本身就参与 RNA 运输。
随后研究人员在 PEG 10 蛋白的 mRNA 中找到了识别和包装 RNA 的分子序列。通过对 FEG 10 蛋白 mRNA 分子包装序列,以及 PEG 10 蛋白进行修饰,研究人员试图让 PEG 10 蛋白搭载不同的 RNA,并靶向不同的细胞。
研究人员开发了两种不同蛋白修饰的 PEG 10 蛋白,并在细胞试验中实现靶细胞 RNA 递送。
对此,张锋教授表示,“我们的研究表明,通过对 PEG 10 蛋白的 RNA 包装组件和识别组件进行改造,理论上就可以针对不同的疾病治疗提供一个模块化的平台。”
由于 SEND 平台所用的 RNA 载体均来源于体内天然蛋白自,这意味着这一系统不会触发机体免疫反应,副作用大大降低。未来,SEND 技术或将替代纳米脂质体和病毒载体,成为适合基因编辑疗法的载体。
下一步,该团队将会在动物体内测试 SEND,并进一步设计和开发更多的逆转录转座子蛋白,以便将更多的 RNA 递送至各个组织和细胞。



