在连续三年保持零本土疟疾病例后,中国在去年向世界卫生组织(WHO)申请了无疟疾认证,日前,WHO正式宣布中国成为全世界第40个消灭疟疾的国家,这无疑是一个伟大的成就。
然而,放眼全球,疟疾仍然是全世界范围内的面临的主要公共卫生问题,每年记录在案的疟疾感染病例超过2亿,死亡人数达40万,其中大多数是儿童。在全球范围内去除疟疾,仍然任重而道远。
疟疾的病原体为疟原虫,疟原虫的生长需要人和按蚊两个宿主,只有成熟的配子体才能通过按蚊传播,所以疟原虫的配子生殖是疟疾传播的关键环节。迄今为止,人们已经陆续发现了一些参与疟原虫配子生殖的重要调控因子如AP2-G, GDV1等,但是对于该过程的核心调控网络仍所知甚少。
2021年8月8日,同济大学和江苏省寄生虫病防治研究所联合研究,在国际期刊 Nucleic Acids Resreach上在线发表了题为“A cascade oftranscriptional repression determines sexual commitment and development inPlasmodium falciparum ”的文章,揭示了疟疾传播的核心调控因子。

DOI:https://hub.pubmedplus.com/10.1093/nar/gkab683
首先,研究团队利用CRISPR-Cas9基因编辑技术对恶性疟原虫ApiAp2转录调控因子家族(人类和啮齿动物疟疾寄生虫性行为的主要调控因子)开展了系统的基因敲除和配子体生成能力的筛选。实验结果表明,一株基因敲除株PF3D7 1139300(在此命名为pfap2-g5)与亲本菌株相比,pfap2-g mRNA丰度显著增加,但配子细胞产生严重缺陷,并通过反复敲除和恢复PfAP2-G5基因水平,证实PfAP2-G5不仅是配子细胞转化所必需的,也是配子细胞发育所必需的。
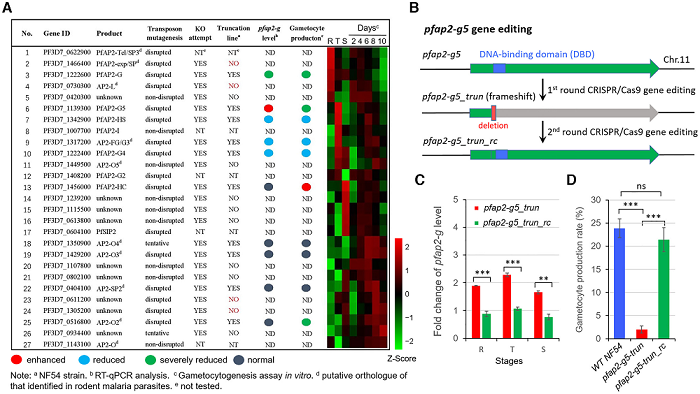
用于配子体生产的 ApiAP2 家族的功能筛选
随后,研究人员对PfAP2-G5进行了功能及机制研究,通过染色质免疫共沉淀和差异转录组分析等实验,鉴定了PfAP2-G5的靶基因及调控机制,结果表明:PfAP2-G5可以通过与上游区域和外显子基因体结合抑制pfap2-g(疟原虫性转换关键基因)基因的转录活性,外显子基因体与维持局部异染色质结构有关,从而阻止性行为的发生,使疟原虫无法进行性转换,只能在体内进行无性复制。
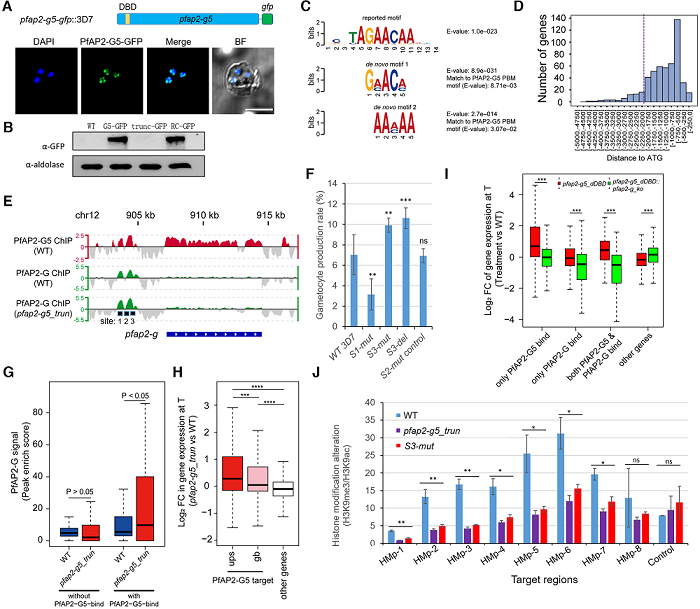
PfAP2-G5抑制pfap2-g基因的转录活性
研究人员还通过实验证明PfAP2-G5对早期配子细胞的发育也起着重要的作用,在疟原虫性转换G0阶段,PfAP2-G能够上调PfAP2-G5以及其他靶基因,使pfap2-g5在G0阶段达到较大转录量,促进早期配子体的发育;但是,当疟原虫发育到G1阶段时,PfAP2-G5能够联合PfAP2-G2,迅速抑制PfAP2-G及其靶基因,而这些早期配子体发育相关基因的快速关闭是配子体成熟的关键。
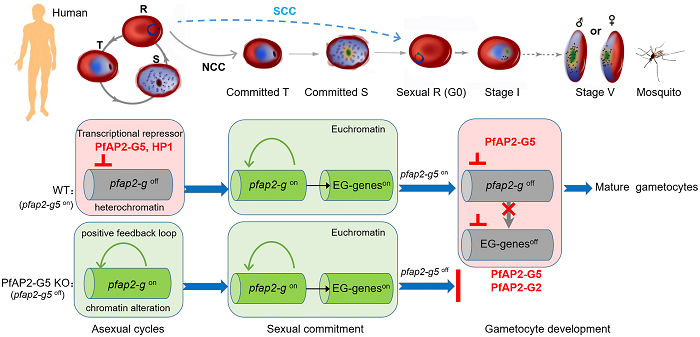
实验机制图
总之,本篇文章发现了PfAP2-G5在配子细胞发生中是不可缺少的。该因子通过与上游区域和外显子基因体结合抑制pfap2-g基因的转录活性,从而阻止性行为的发生。进一步的分析表明,PfAP2-G5在配子细胞成熟过程中是必不可少的,并导致pfap2-g和一组在配子细胞发育之前被pfap2-g激活的早期配子细胞基因的下调。总的来说,本研究揭示了疟原虫配子细胞产生的级联调控,并为阻断传播干预提供了一个新的靶点。



