摘要:瑞典研究人员现在已经确定了一个特定钙通道的确切位置。
当疼痛信号通过神经系统传递时,一种叫做钙通道的蛋白质起着关键作用。瑞典Linköping大学的研究人员现在已经确定了一个特定钙通道的确切位置,该通道可以微调疼痛信号的强度。这些知识可以用来开发治疗慢性疼痛的药物,这些药物更有效,副作用更少。
痛觉和其他信息主要以电信号的形式通过我们的神经系统传导。然而,在关键时刻,这些信息以特定分子的形式转化为生化信号。为了开发未来的止痛药物,研究人员必须了解疼痛信号从一种形式转化为另一种形式时分子水平上发生的细节。
 图1 CaV2.2(N型)通道的电压依赖性G蛋白调控
图1 CaV2.2(N型)通道的电压依赖性G蛋白调控当电信号到达一个神经细胞的末端时,它就以钙的形式转化为生化信号。反过来,钙的增加会触发被称为神经递质的信号分子的释放。这种生化信号被下一个神经细胞接收,并将信号转换回电。在神经系统的这条信息传递链上,一类蛋白质引起了特别的兴趣:电压敏感的钙离子通道。这些通道就像感知电信号的分子机器,然后打开,允许钙流入神经细胞。
在目前的研究中,Linköping大学的研究人员专注于一种名为CaV2.2的钙通道,它与疼痛信号的传递有关。事实上,这些通道在慢性疼痛时更加活跃。它们特别位于感觉神经细胞的末端。
抑制它们活动的药物减少了从感觉神经细胞到大脑的疼痛信号的交流。这样的药物是存在的,但有一个问题:完全阻断CaV2.2的药物有非常严重的副作用,需要直接给药到脊髓液中。减少CaV2.2数量的药物,如加巴喷丁,并不能非常有效地减轻慢性疼痛。另一类利用自然机制来降低CaV2.2对疼痛信号反应能力的药物是阿片类药物,如吗啡和海洛因。虽然在止痛方面非常有效,但它们也会让人上瘾,并导致毁灭性的依赖。
“钙通道是非常有吸引力的疼痛治疗药物靶点,但目前的解决方案还不够,”Link?ping大学生物医学和临床科学系副教授Antonios Pantazis说,他领导了这项发表在《Science Advances》杂志上的研究。
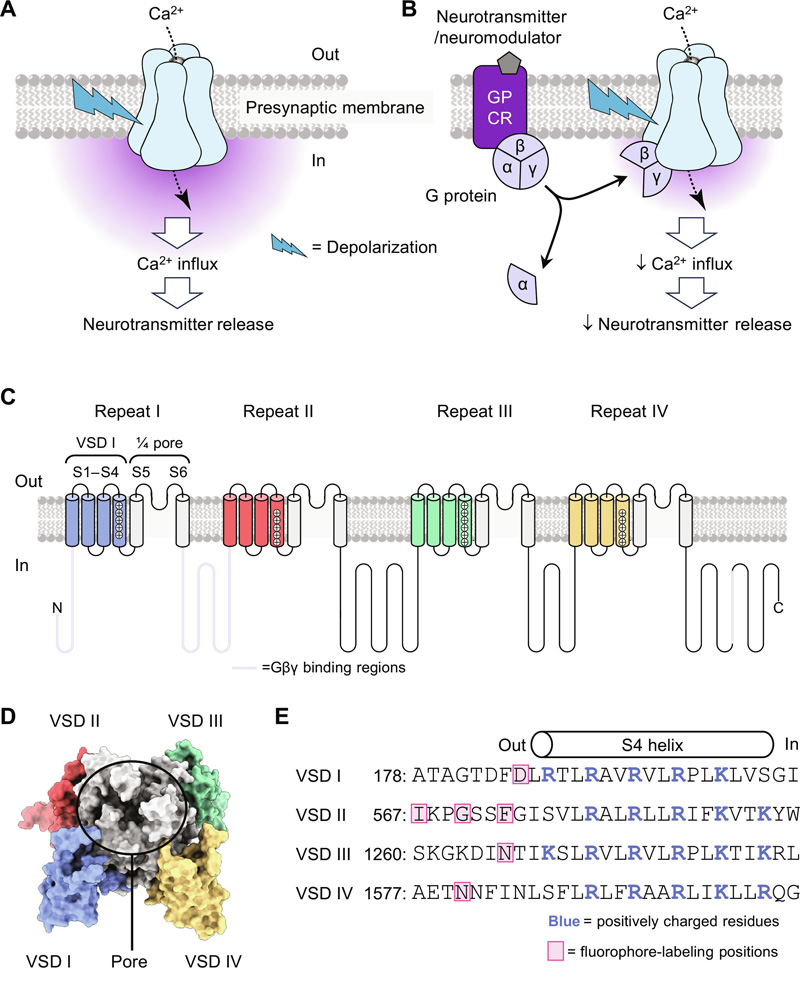
图2 CaV2.2功能、G蛋白抑制和结构
研究人员研究了阿片类药物降低CaV2.2活性的机制。人们早就知道,阿片类药物会释放一种叫做G蛋白的分子,这种分子直接与钙通道结合,使它们“不愿”打开。但这是如何发生的呢?生物医学和临床科学系Antonios Pantazis这就好像G蛋白信号导致通道需要更多的“说服”——就更强的电信号而言——才能打开。在我们的研究中,我们在分子水平上描述了这是如何完成的。”
在钙通道中有四个所谓的电压传感器,用来检测神经电脉冲。当电压足够高时,电压传感器移动并打开通道,使钙可以流过。研究人员使用微小的发光分子来检测这些电压传感器如何响应电信号而移动。他们发现,G蛋白会影响特定电压传感器的功能,而不会影响其他传感器,使它们更“不愿意”感知电信号。
“我们的发现指向了大钙通道的一个非常特定的部分,下一代药物可以以类似于阿片类药物的方式提供疼痛缓解。而不是完全阻断钙通道,这是一种不太精细的方法,未来的药物可以设计成微调疼痛信号中的钙通道活动,”Antonios Pantazis说。
希望未来设计的影响CaV2.2钙通道的药物能有更好的镇痛效果,副作用更小。
参考资料
[1] Voltage-dependent G-protein regulation of CaV2.2 (N-type) channels
摘要:瑞典研究人员现在已经确定了一个特定钙通道的确切位置。
当疼痛信号通过神经系统传递时,一种叫做钙通道的蛋白质起着关键作用。瑞典Linköping大学的研究人员现在已经确定了一个特定钙通道的确切位置,该通道可以微调疼痛信号的强度。这些知识可以用来开发治疗慢性疼痛的药物,这些药物更有效,副作用更少。
痛觉和其他信息主要以电信号的形式通过我们的神经系统传导。然而,在关键时刻,这些信息以特定分子的形式转化为生化信号。为了开发未来的止痛药物,研究人员必须了解疼痛信号从一种形式转化为另一种形式时分子水平上发生的细节。
 图1 CaV2.2(N型)通道的电压依赖性G蛋白调控
图1 CaV2.2(N型)通道的电压依赖性G蛋白调控当电信号到达一个神经细胞的末端时,它就以钙的形式转化为生化信号。反过来,钙的增加会触发被称为神经递质的信号分子的释放。这种生化信号被下一个神经细胞接收,并将信号转换回电。在神经系统的这条信息传递链上,一类蛋白质引起了特别的兴趣:电压敏感的钙离子通道。这些通道就像感知电信号的分子机器,然后打开,允许钙流入神经细胞。
在目前的研究中,Linköping大学的研究人员专注于一种名为CaV2.2的钙通道,它与疼痛信号的传递有关。事实上,这些通道在慢性疼痛时更加活跃。它们特别位于感觉神经细胞的末端。
抑制它们活动的药物减少了从感觉神经细胞到大脑的疼痛信号的交流。这样的药物是存在的,但有一个问题:完全阻断CaV2.2的药物有非常严重的副作用,需要直接给药到脊髓液中。减少CaV2.2数量的药物,如加巴喷丁,并不能非常有效地减轻慢性疼痛。另一类利用自然机制来降低CaV2.2对疼痛信号反应能力的药物是阿片类药物,如吗啡和海洛因。虽然在止痛方面非常有效,但它们也会让人上瘾,并导致毁灭性的依赖。
“钙通道是非常有吸引力的疼痛治疗药物靶点,但目前的解决方案还不够,”Link?ping大学生物医学和临床科学系副教授Antonios Pantazis说,他领导了这项发表在《Science Advances》杂志上的研究。

图2 CaV2.2功能、G蛋白抑制和结构
研究人员研究了阿片类药物降低CaV2.2活性的机制。人们早就知道,阿片类药物会释放一种叫做G蛋白的分子,这种分子直接与钙通道结合,使它们“不愿”打开。但这是如何发生的呢?生物医学和临床科学系Antonios Pantazis这就好像G蛋白信号导致通道需要更多的“说服”——就更强的电信号而言——才能打开。在我们的研究中,我们在分子水平上描述了这是如何完成的。”
在钙通道中有四个所谓的电压传感器,用来检测神经电脉冲。当电压足够高时,电压传感器移动并打开通道,使钙可以流过。研究人员使用微小的发光分子来检测这些电压传感器如何响应电信号而移动。他们发现,G蛋白会影响特定电压传感器的功能,而不会影响其他传感器,使它们更“不愿意”感知电信号。
“我们的发现指向了大钙通道的一个非常特定的部分,下一代药物可以以类似于阿片类药物的方式提供疼痛缓解。而不是完全阻断钙通道,这是一种不太精细的方法,未来的药物可以设计成微调疼痛信号中的钙通道活动,”Antonios Pantazis说。
希望未来设计的影响CaV2.2钙通道的药物能有更好的镇痛效果,副作用更小。
参考资料
[1] Voltage-dependent G-protein regulation of CaV2.2 (N-type) channels



