摘要:一种通常用于治疗青光眼的药物已经在斑马鱼和小鼠身上被证明可以防止大脑中tau蛋白的积累。
一种通常用于治疗青光眼的药物已经在斑马鱼和小鼠身上被证明可以防止大脑中tau蛋白的积累,这种蛋白会导致各种形式的痴呆,并与阿尔茨海默病有关。
剑桥大学英国痴呆症研究所的研究人员筛选了1400多种临床批准的药物化合物,使用斑马鱼进行基因工程改造,使它们模拟所谓的牛头病。他们发现碳酸酐酶抑制剂(治疗青光眼的药物甲唑胺就是其中一种)可以清除斑马鱼和小鼠体内的tau蛋白积聚,并减少这种疾病的迹象。斑马鱼和小鼠体内携带着导致人类痴呆的突变形式的tau蛋白。

图1 碳酸酐酶抑制通过增强tau蛋白分泌改善tau蛋白毒性
tau病是一种神经退行性疾病,其特征是大脑中神经细胞内tau蛋白“聚集体”的积聚。这些疾病包括各种形式的痴呆症、匹克病和进行性核上性麻痹,其中tau被认为是主要的疾病驱动因素,以及阿尔茨海默病和慢性创伤性脑病(由反复头部创伤引起的神经变性,正如足球和橄榄球运动员所报道的那样),其中tau积聚是疾病的一个后果,但会导致脑组织退化。
在寻找治疗这些疾病的有效药物方面进展甚微。一种选择是重新利用现有药物。然而,药物筛选——对化合物进行疾病模型测试——通常在细胞培养中进行,但是这些并不能捕捉到活生物体中tau积聚的许多特征。
为了解决这个问题,剑桥团队求助于他们之前开发的斑马鱼模型。斑马鱼长大成熟,能够在两到三个月内繁殖,并产生大量的后代。利用基因操作,模仿人类疾病是可能的,因为许多导致人类疾病的基因通常在斑马鱼中有等同的基因。
在今天发表在《Nature Chemical Biology》上的一项研究中,David Rubinsztein教授、Angeleen Fleming博士及其同事模拟了斑马鱼的脑损伤,并筛选了1437种药物化合物。这些化合物中的每一种都已被临床批准用于治疗其他疾病。
剑桥医学研究所生理学、发育和神经科学系以及剑桥大学英国痴呆症研究所的Ana Lopez Ramirez博士是该研究的第一作者,他说:“斑马鱼提供了一种比细胞培养更有效、更现实的筛选药物化合物的方法,而细胞培养的功能与生物体完全不同。它们还使我们能够大规模地这样做,这在小鼠等大型动物身上是不可行的,也不符合道德标准。”
通过这种方法,研究小组发现,抑制一种被称为碳酸酐酶的酶——它对调节细胞中的酸度水平很重要——有助于细胞摆脱tau蛋白的积累。它通过使溶酶体——“细胞的焚化炉”——移动到细胞表面,在那里它们与细胞膜融合并“吐出”tau蛋白。
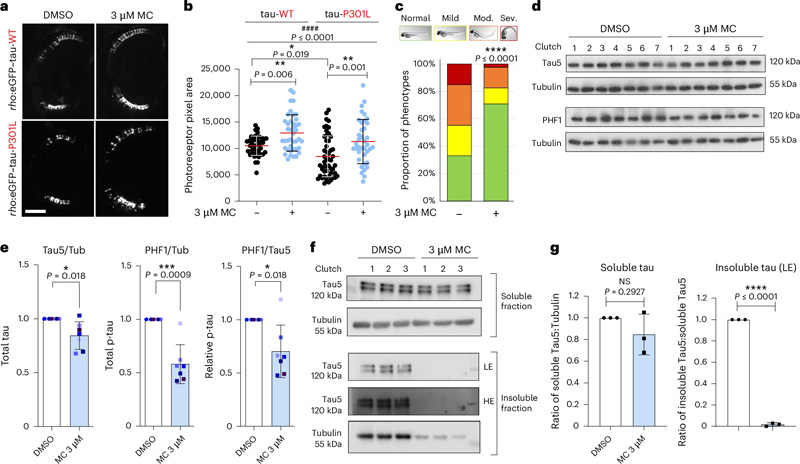
图2 甲氧卡巴醇改善了斑马鱼模型中tau诱导的毒性,并降低了过度磷酸化和不溶性tau水平
当研究小组对携带tau蛋白P301S人类致病突变基因的小鼠进行甲基唑胺测试时,他们发现,与未治疗的小鼠相比,接受药物治疗的小鼠在记忆任务中表现更好,认知表现也有所改善。
对小鼠大脑的分析表明,与未治疗的小鼠相比,它们确实有更少的tau蛋白聚集物,因此脑细胞的减少也更少。
同样来自剑桥医学研究所和英国痴呆症研究所的合著者Farah Siddiqi博士说:“我们很高兴地看到,在我们的小鼠研究中,甲基唑胺降低了大脑中tau蛋白的水平,并防止其进一步积聚。这证实了我们在使用斑马鱼病变模型筛选碳酸酐酶抑制剂时所显示的结果。”
甲巯咪唑胺有望成为一种急需的药物,帮助防止大脑中危险的tau蛋白的积累。虽然我们只研究了它在斑马鱼和小鼠身上的效果,所以它还处于早期阶段,但我们至少知道这种药物在病人身上的安全性。如果我们从零开始使用一种未知的药物化合物,这将使我们能够更快地进入临床试验。
来自英国痴呆症研究所和剑桥大学剑桥医学研究所的Rubinsztein教授说:“这表明我们可以利用斑马鱼来测试现有药物是否可以重新用于治疗不同的疾病,这可能会大大加快药物发现过程。”
该团队希望在不同的疾病模型上测试甲基唑胺,包括以易聚集蛋白积聚为特征的更常见的疾病,如亨廷顿氏病和帕金森病。
参考资料
[1] Carbonic anhydrase inhibition ameliorates tau toxicity via enhanced tau secretion
摘要:一种通常用于治疗青光眼的药物已经在斑马鱼和小鼠身上被证明可以防止大脑中tau蛋白的积累。
一种通常用于治疗青光眼的药物已经在斑马鱼和小鼠身上被证明可以防止大脑中tau蛋白的积累,这种蛋白会导致各种形式的痴呆,并与阿尔茨海默病有关。
剑桥大学英国痴呆症研究所的研究人员筛选了1400多种临床批准的药物化合物,使用斑马鱼进行基因工程改造,使它们模拟所谓的牛头病。他们发现碳酸酐酶抑制剂(治疗青光眼的药物甲唑胺就是其中一种)可以清除斑马鱼和小鼠体内的tau蛋白积聚,并减少这种疾病的迹象。斑马鱼和小鼠体内携带着导致人类痴呆的突变形式的tau蛋白。

图1 碳酸酐酶抑制通过增强tau蛋白分泌改善tau蛋白毒性
tau病是一种神经退行性疾病,其特征是大脑中神经细胞内tau蛋白“聚集体”的积聚。这些疾病包括各种形式的痴呆症、匹克病和进行性核上性麻痹,其中tau被认为是主要的疾病驱动因素,以及阿尔茨海默病和慢性创伤性脑病(由反复头部创伤引起的神经变性,正如足球和橄榄球运动员所报道的那样),其中tau积聚是疾病的一个后果,但会导致脑组织退化。
在寻找治疗这些疾病的有效药物方面进展甚微。一种选择是重新利用现有药物。然而,药物筛选——对化合物进行疾病模型测试——通常在细胞培养中进行,但是这些并不能捕捉到活生物体中tau积聚的许多特征。
为了解决这个问题,剑桥团队求助于他们之前开发的斑马鱼模型。斑马鱼长大成熟,能够在两到三个月内繁殖,并产生大量的后代。利用基因操作,模仿人类疾病是可能的,因为许多导致人类疾病的基因通常在斑马鱼中有等同的基因。
在今天发表在《Nature Chemical Biology》上的一项研究中,David Rubinsztein教授、Angeleen Fleming博士及其同事模拟了斑马鱼的脑损伤,并筛选了1437种药物化合物。这些化合物中的每一种都已被临床批准用于治疗其他疾病。
剑桥医学研究所生理学、发育和神经科学系以及剑桥大学英国痴呆症研究所的Ana Lopez Ramirez博士是该研究的第一作者,他说:“斑马鱼提供了一种比细胞培养更有效、更现实的筛选药物化合物的方法,而细胞培养的功能与生物体完全不同。它们还使我们能够大规模地这样做,这在小鼠等大型动物身上是不可行的,也不符合道德标准。”
通过这种方法,研究小组发现,抑制一种被称为碳酸酐酶的酶——它对调节细胞中的酸度水平很重要——有助于细胞摆脱tau蛋白的积累。它通过使溶酶体——“细胞的焚化炉”——移动到细胞表面,在那里它们与细胞膜融合并“吐出”tau蛋白。

图2 甲氧卡巴醇改善了斑马鱼模型中tau诱导的毒性,并降低了过度磷酸化和不溶性tau水平
当研究小组对携带tau蛋白P301S人类致病突变基因的小鼠进行甲基唑胺测试时,他们发现,与未治疗的小鼠相比,接受药物治疗的小鼠在记忆任务中表现更好,认知表现也有所改善。
对小鼠大脑的分析表明,与未治疗的小鼠相比,它们确实有更少的tau蛋白聚集物,因此脑细胞的减少也更少。
同样来自剑桥医学研究所和英国痴呆症研究所的合著者Farah Siddiqi博士说:“我们很高兴地看到,在我们的小鼠研究中,甲基唑胺降低了大脑中tau蛋白的水平,并防止其进一步积聚。这证实了我们在使用斑马鱼病变模型筛选碳酸酐酶抑制剂时所显示的结果。”
甲巯咪唑胺有望成为一种急需的药物,帮助防止大脑中危险的tau蛋白的积累。虽然我们只研究了它在斑马鱼和小鼠身上的效果,所以它还处于早期阶段,但我们至少知道这种药物在病人身上的安全性。如果我们从零开始使用一种未知的药物化合物,这将使我们能够更快地进入临床试验。
来自英国痴呆症研究所和剑桥大学剑桥医学研究所的Rubinsztein教授说:“这表明我们可以利用斑马鱼来测试现有药物是否可以重新用于治疗不同的疾病,这可能会大大加快药物发现过程。”
该团队希望在不同的疾病模型上测试甲基唑胺,包括以易聚集蛋白积聚为特征的更常见的疾病,如亨廷顿氏病和帕金森病。
参考资料
[1] Carbonic anhydrase inhibition ameliorates tau toxicity via enhanced tau secretion



