摘要:研究人员发现了导致神经退行性疾病的有害蛋白质聚集体形成的突破性机制。
熊本大学的一组研究人员发现了导致神经退行性疾病(如帕金森病)的有害蛋白质聚集体形成的突破性机制。由Norifumi Shioda教授和Yasushi Yabuki副教授领导的研究小组首次发现,一种名为G-四重复合物(G4s)的独特RNA结构在促进α-突触核蛋白(一种与神经变性相关的蛋白质)的聚集中起着核心作用。通过证明抑制G4组装可能潜在地阻止突触核蛋白病的发生,这一发现将G4定位为这些疾病早期干预的有希望的靶点。
在健康状态下,α-突触核蛋白通常调节神经元功能。然而,在神经退行性疾病中,它聚集在一起,导致细胞损伤和运动症状。研究人员发现G4s,一种响应细胞压力形成的四链RNA结构,具有促进α-突触核蛋白聚集的“支架”功能。经常在压力下出现的钙水平升高,触发G4组装,然后吸引α-突触核蛋白,将其转化为有害的,易于聚集的状态。

图1 RNA G-四链体形成促进神经病理学α-突触核蛋白聚集的支架
该团队更进一步,展示了一种防止这一过程的新方法。他们使用5-氨基乙酰丙酸(5-ALA),一种阻断G4形成的化合物,来模拟表现出帕金森样症状的小鼠。令人印象深刻的是,5-ALA治疗不仅可以阻止α-突触核蛋白聚集,还可以阻止运动症状的进展,这是针对早期神经变性的潜在治疗的一个有希望的迹象。
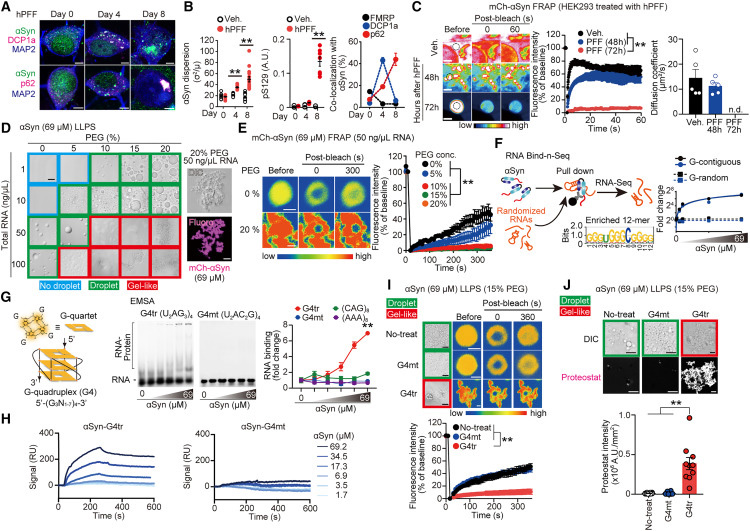
图2 rG4s引发α-Syn溶胶-凝胶相变
这一突破可以通过专注于G4调节来显著推进针对神经退行性疾病的治疗。由于G4s也与阿尔茨海默病等其他疾病有关,这一发现可能会将此类治疗的影响扩大到帕金森病之外。这些发现发表在2024年10月18日的《Cell》杂志上,为预防神经退行性疾病和提高老年人的生活质量提供了新的思路。
参考资料
[1] RNA G-quadruplexes form scaffolds that promote neuropathological α-synuclein aggregation
摘要:研究人员发现了导致神经退行性疾病的有害蛋白质聚集体形成的突破性机制。
熊本大学的一组研究人员发现了导致神经退行性疾病(如帕金森病)的有害蛋白质聚集体形成的突破性机制。由Norifumi Shioda教授和Yasushi Yabuki副教授领导的研究小组首次发现,一种名为G-四重复合物(G4s)的独特RNA结构在促进α-突触核蛋白(一种与神经变性相关的蛋白质)的聚集中起着核心作用。通过证明抑制G4组装可能潜在地阻止突触核蛋白病的发生,这一发现将G4定位为这些疾病早期干预的有希望的靶点。
在健康状态下,α-突触核蛋白通常调节神经元功能。然而,在神经退行性疾病中,它聚集在一起,导致细胞损伤和运动症状。研究人员发现G4s,一种响应细胞压力形成的四链RNA结构,具有促进α-突触核蛋白聚集的“支架”功能。经常在压力下出现的钙水平升高,触发G4组装,然后吸引α-突触核蛋白,将其转化为有害的,易于聚集的状态。

图1 RNA G-四链体形成促进神经病理学α-突触核蛋白聚集的支架
该团队更进一步,展示了一种防止这一过程的新方法。他们使用5-氨基乙酰丙酸(5-ALA),一种阻断G4形成的化合物,来模拟表现出帕金森样症状的小鼠。令人印象深刻的是,5-ALA治疗不仅可以阻止α-突触核蛋白聚集,还可以阻止运动症状的进展,这是针对早期神经变性的潜在治疗的一个有希望的迹象。

图2 rG4s引发α-Syn溶胶-凝胶相变
这一突破可以通过专注于G4调节来显著推进针对神经退行性疾病的治疗。由于G4s也与阿尔茨海默病等其他疾病有关,这一发现可能会将此类治疗的影响扩大到帕金森病之外。这些发现发表在2024年10月18日的《Cell》杂志上,为预防神经退行性疾病和提高老年人的生活质量提供了新的思路。
参考资料
[1] RNA G-quadruplexes form scaffolds that promote neuropathological α-synuclein aggregation



