摘要:肿瘤细胞抑制核糖体功能逃避免疫应答的发现。
来自荷兰癌症研究所的William James Faller领导的一个研究小组发现了癌细胞用来实现免疫逃避的一种新机制。
他们的研究发表在10月22日的权威杂志《Cell》上,揭示了癌细胞如何干扰核糖体功能,影响免疫反应并导致免疫逃逸。

图1 P-柄核糖体是细胞因子介导过程的主要调节因子
主要发现:核糖体和T细胞反应
该研究强调了一种称为P-stalk核糖体(PSR)的独特核糖体亚基的作用。当免疫细胞如T细胞分泌干扰素-γ (IFN-γ)和肿瘤坏死因子-α (TNF-α)等细胞因子时,这些细胞因子诱导PSRs的形成。PSRs通过翻译关键的免疫相关分子来增强抗原加工和递呈,使T细胞更容易识别和杀死癌细胞。
然而,研究人员发现PSRs的缺失会损害CD8+ T细胞识别和破坏癌细胞的能力。此外,某些免疫抑制因子如TGF-β阻碍PSR的形成,帮助癌细胞避免免疫检测。
分子拔河比赛
这项研究提供了一个新的视角:核糖体,通常作为“蛋白质工厂”的功能,在免疫反应中起着关键作用。在接收到来自T细胞的信号后,核糖体应该增加分子的产生,使癌细胞受到免疫攻击。然而,癌细胞已经发展出阻止这一过程的机制,破坏核糖体功能并隐藏自己免受免疫监视。
这一发现通过关注核糖体在免疫信号存在下是如何调节的,为癌症免疫治疗提供了有希望的新靶点。
为什么核糖体在癌症免疫中很重要
Faller团队对核糖体的兴趣源于先前的研究,将核糖体蛋白与T细胞存活、树突状细胞激活和免疫系统检测癌细胞的能力联系起来。具体来说,核糖体蛋白可以影响MHC I类肽的产生,这对免疫监测至关重要。
在目前的研究中,研究人员用IFN-γ和TNF-α治疗黑色素瘤细胞,并分析核糖体蛋白组成的变化。他们观察到P柄核糖体的关键成分P1和P2蛋白的水平随着这些细胞因子的增加而增加。值得注意的是,并非所有核糖体蛋白都受到影响,这表明这种变化是高度特异性的。
PSR的形成和免疫抑制
进一步分析证实,PSR水平随着暴露于各种免疫激活因子(如IFN-α、IFN-β和IL-1β)而升高,但在免疫抑制因子TGF-β的影响下下降。这一现象在多个癌细胞系中被观察到,表明该机制是普遍存在的。
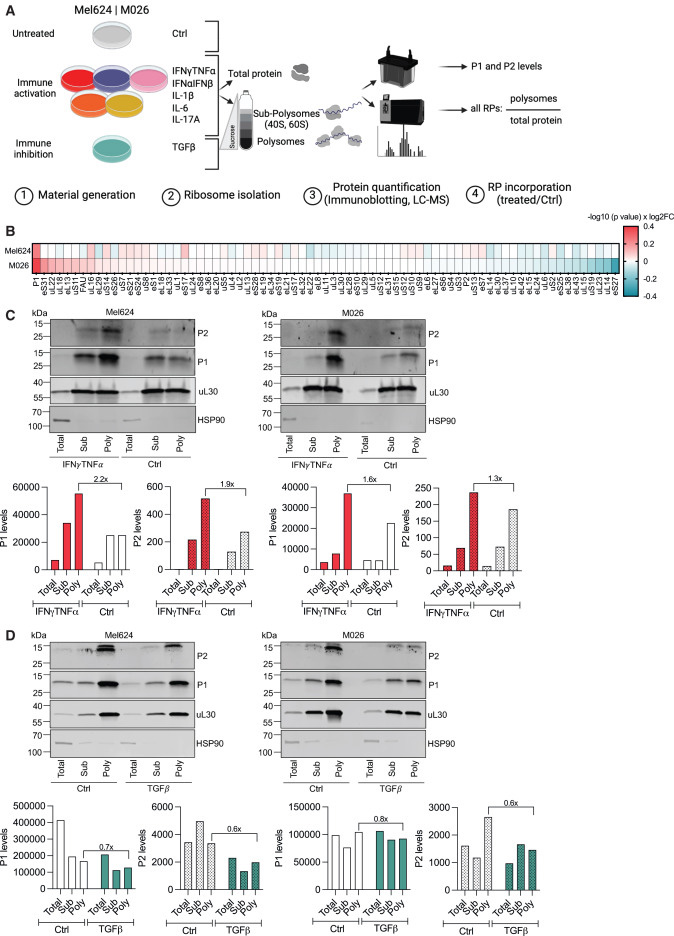
图2 P-柄定义了一种细胞因子反应性核糖体亚群
为了了解功能上的影响,研究人员敲除了P1基因来制造PSR缺陷细胞。这些修饰过的细胞表面HLA-A/B/C分子水平较低,降低了它们对免疫细胞的可见性。与T细胞共培养实验表明,这些PSR缺陷的癌细胞对T细胞介导的杀伤不太敏感。
临床见解和更广泛的影响
研究人员分析了来自TCGA(癌症基因组图谱)的数据,发现高P1/P2蛋白水平与黑色素瘤细胞中IFN-γ和CD8+ T细胞活性增加呈正相关。在分析的36种癌症类型中,有24种观察到类似的趋势,这表明PSR调节是癌症免疫反应的共同特征。
该研究还表明,PSR缺陷会损害巨噬细胞抗原的加工和递呈,进一步损害免疫应答。
此外,Faller的团队探索了P1和P2蛋白的磷酸化如何调节它们与核糖体的附着。IFN-γ和TNF-α诱导的去磷酸化促进PSR的形成,增强免疫应答。
结论:肿瘤免疫治疗的新靶点
该研究为P-柄核糖体在调节免疫反应中的作用提供了开创性的见解。PSRs选择性地翻译与免疫信号相关的mRNA,其形成受促炎性和抗炎性细胞因子的控制。然而,PSRs优先处理某些mRNA的确切机制尚不清楚,需要进一步研究。
这一发现提示PSR功能障碍可能是癌细胞逃避免疫检测的一种策略,为加强癌症免疫治疗提供了新的治疗靶点。未来的研究可以探索调节PSRs的方法,以提高免疫系统对各种癌症类型肿瘤的性能。
参考资料
[1] P-stalk ribosomes act as master regulators of cytokine-mediated processes
摘要:肿瘤细胞抑制核糖体功能逃避免疫应答的发现。
来自荷兰癌症研究所的William James Faller领导的一个研究小组发现了癌细胞用来实现免疫逃避的一种新机制。
他们的研究发表在10月22日的权威杂志《Cell》上,揭示了癌细胞如何干扰核糖体功能,影响免疫反应并导致免疫逃逸。

图1 P-柄核糖体是细胞因子介导过程的主要调节因子
主要发现:核糖体和T细胞反应
该研究强调了一种称为P-stalk核糖体(PSR)的独特核糖体亚基的作用。当免疫细胞如T细胞分泌干扰素-γ (IFN-γ)和肿瘤坏死因子-α (TNF-α)等细胞因子时,这些细胞因子诱导PSRs的形成。PSRs通过翻译关键的免疫相关分子来增强抗原加工和递呈,使T细胞更容易识别和杀死癌细胞。
然而,研究人员发现PSRs的缺失会损害CD8+ T细胞识别和破坏癌细胞的能力。此外,某些免疫抑制因子如TGF-β阻碍PSR的形成,帮助癌细胞避免免疫检测。
分子拔河比赛
这项研究提供了一个新的视角:核糖体,通常作为“蛋白质工厂”的功能,在免疫反应中起着关键作用。在接收到来自T细胞的信号后,核糖体应该增加分子的产生,使癌细胞受到免疫攻击。然而,癌细胞已经发展出阻止这一过程的机制,破坏核糖体功能并隐藏自己免受免疫监视。
这一发现通过关注核糖体在免疫信号存在下是如何调节的,为癌症免疫治疗提供了有希望的新靶点。
为什么核糖体在癌症免疫中很重要
Faller团队对核糖体的兴趣源于先前的研究,将核糖体蛋白与T细胞存活、树突状细胞激活和免疫系统检测癌细胞的能力联系起来。具体来说,核糖体蛋白可以影响MHC I类肽的产生,这对免疫监测至关重要。
在目前的研究中,研究人员用IFN-γ和TNF-α治疗黑色素瘤细胞,并分析核糖体蛋白组成的变化。他们观察到P柄核糖体的关键成分P1和P2蛋白的水平随着这些细胞因子的增加而增加。值得注意的是,并非所有核糖体蛋白都受到影响,这表明这种变化是高度特异性的。
PSR的形成和免疫抑制
进一步分析证实,PSR水平随着暴露于各种免疫激活因子(如IFN-α、IFN-β和IL-1β)而升高,但在免疫抑制因子TGF-β的影响下下降。这一现象在多个癌细胞系中被观察到,表明该机制是普遍存在的。

图2 P-柄定义了一种细胞因子反应性核糖体亚群
为了了解功能上的影响,研究人员敲除了P1基因来制造PSR缺陷细胞。这些修饰过的细胞表面HLA-A/B/C分子水平较低,降低了它们对免疫细胞的可见性。与T细胞共培养实验表明,这些PSR缺陷的癌细胞对T细胞介导的杀伤不太敏感。
临床见解和更广泛的影响
研究人员分析了来自TCGA(癌症基因组图谱)的数据,发现高P1/P2蛋白水平与黑色素瘤细胞中IFN-γ和CD8+ T细胞活性增加呈正相关。在分析的36种癌症类型中,有24种观察到类似的趋势,这表明PSR调节是癌症免疫反应的共同特征。
该研究还表明,PSR缺陷会损害巨噬细胞抗原的加工和递呈,进一步损害免疫应答。
此外,Faller的团队探索了P1和P2蛋白的磷酸化如何调节它们与核糖体的附着。IFN-γ和TNF-α诱导的去磷酸化促进PSR的形成,增强免疫应答。
结论:肿瘤免疫治疗的新靶点
该研究为P-柄核糖体在调节免疫反应中的作用提供了开创性的见解。PSRs选择性地翻译与免疫信号相关的mRNA,其形成受促炎性和抗炎性细胞因子的控制。然而,PSRs优先处理某些mRNA的确切机制尚不清楚,需要进一步研究。
这一发现提示PSR功能障碍可能是癌细胞逃避免疫检测的一种策略,为加强癌症免疫治疗提供了新的治疗靶点。未来的研究可以探索调节PSRs的方法,以提高免疫系统对各种癌症类型肿瘤的性能。
参考资料
[1] P-stalk ribosomes act as master regulators of cytokine-mediated processes



