摘要:研究人员发现,肠道炎症会在肠道干细胞(ISCs)上留下长期印记,从而降低它们愈合肠道的能力。
贝勒医学院(Baylor College of Medicine)、密歇根大学(University of Michigan)和合作机构的研究人员发现,肠道炎症会在肠道干细胞(ISCs)上留下长期印记,从而降低它们愈合肠道的能力,即使在炎症消退后也是如此。这一点很重要,因为它影响到ISCs对未来挑战的反应。这项研究发表在《细胞干细胞》杂志上。
“我们研究移植物抗宿主病(GVHD),这是骨髓移植后死亡的主要原因,是许多血液疾病的潜在治疗方法。我们的目标之一是更好地了解GVHD并确定控制它的策略,”通讯作者Pavan Reddy博士说,他是贝勒大学Dan L Duncan综合癌症中心的教授和主任,之前曾在密歇根大学工作。

图1 炎症诱导的表观遗传印记调节肠干细胞
“GVHD是一种炎症反应,来自骨髓移植供体的免疫T细胞攻击宿主肠道细胞,主要是ISCs,”Reddy实验室的第一作者Dongchang Zhao博士说。
虽然许多ISCs在GVHD期间死亡,但幸存者仍然存在。然而,目前尚不清楚它们在GVHD解决后是否能够完全发挥功能或恢复其全部功能,这对宿主的恢复和修复具有根本意义。
Reddy说:“在目前的研究中,我们在明确定义的GVHD临床相关模型中研究了炎症对ISCs的影响。”
Zhao说:“通过细胞和动物模型,我们发现暴露于炎症会导致ISCs改变其代谢,从而导致琥珀酸盐的积累,这是细胞过程的产物,反过来又重新编程了表观基因组。”
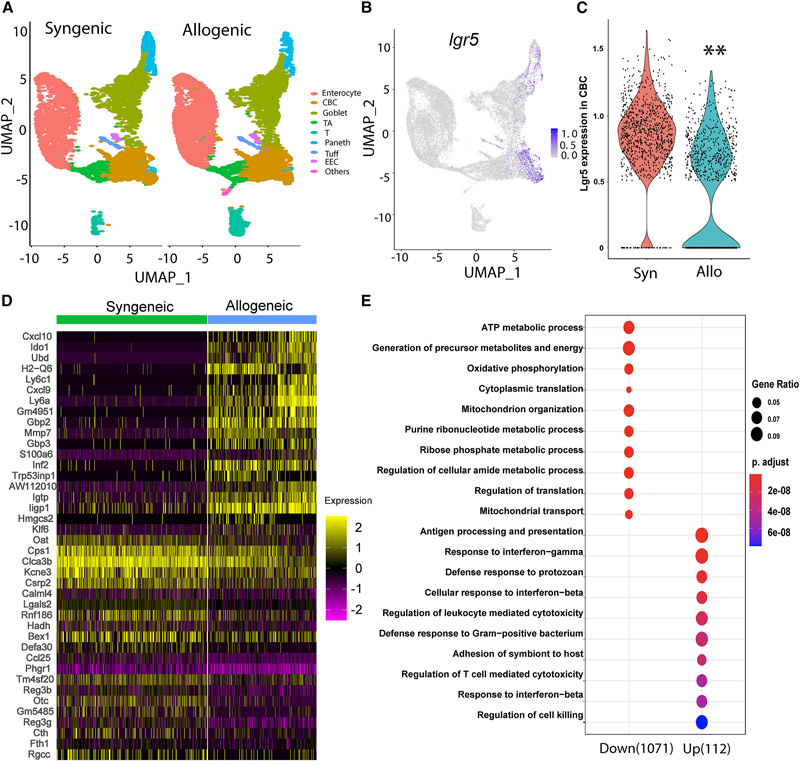
图2 肠移植物抗宿主病后Lgr5+ISCs的单细胞转录组学分析
表观基因组是DNA上的化学标记系统,它调节细胞表达的基因。炎症导致的表观基因组重编程改变了参与细胞繁殖的基因的表达。总的来说,重编程的干细胞再生能力较差,这是愈合肠道的第一步。
“然后我们研究了炎症消退后,ISCs是否能够恢复其再生能力,”Reddy说。“我们发现ISCs并没有克服最初的炎症暴露。尽管在28天内减轻了GVHD炎症,但在动物模型中,ISCs保留了较低的再生能力,导致恢复不良,并增加了非致命辐射暴露等挑战的死亡率。更多的研究正在设计策略,帮助ISCs '忘记'他们遇到的炎症,增强他们抵御免疫攻击的能力。”
参考资料
[1] Inflammation-induced epigenetic imprinting regulates intestinal stem cells
摘要:研究人员发现,肠道炎症会在肠道干细胞(ISCs)上留下长期印记,从而降低它们愈合肠道的能力。
贝勒医学院(Baylor College of Medicine)、密歇根大学(University of Michigan)和合作机构的研究人员发现,肠道炎症会在肠道干细胞(ISCs)上留下长期印记,从而降低它们愈合肠道的能力,即使在炎症消退后也是如此。这一点很重要,因为它影响到ISCs对未来挑战的反应。这项研究发表在《细胞干细胞》杂志上。
“我们研究移植物抗宿主病(GVHD),这是骨髓移植后死亡的主要原因,是许多血液疾病的潜在治疗方法。我们的目标之一是更好地了解GVHD并确定控制它的策略,”通讯作者Pavan Reddy博士说,他是贝勒大学Dan L Duncan综合癌症中心的教授和主任,之前曾在密歇根大学工作。

图1 炎症诱导的表观遗传印记调节肠干细胞
“GVHD是一种炎症反应,来自骨髓移植供体的免疫T细胞攻击宿主肠道细胞,主要是ISCs,”Reddy实验室的第一作者Dongchang Zhao博士说。
虽然许多ISCs在GVHD期间死亡,但幸存者仍然存在。然而,目前尚不清楚它们在GVHD解决后是否能够完全发挥功能或恢复其全部功能,这对宿主的恢复和修复具有根本意义。
Reddy说:“在目前的研究中,我们在明确定义的GVHD临床相关模型中研究了炎症对ISCs的影响。”
Zhao说:“通过细胞和动物模型,我们发现暴露于炎症会导致ISCs改变其代谢,从而导致琥珀酸盐的积累,这是细胞过程的产物,反过来又重新编程了表观基因组。”

图2 肠移植物抗宿主病后Lgr5+ISCs的单细胞转录组学分析
表观基因组是DNA上的化学标记系统,它调节细胞表达的基因。炎症导致的表观基因组重编程改变了参与细胞繁殖的基因的表达。总的来说,重编程的干细胞再生能力较差,这是愈合肠道的第一步。
“然后我们研究了炎症消退后,ISCs是否能够恢复其再生能力,”Reddy说。“我们发现ISCs并没有克服最初的炎症暴露。尽管在28天内减轻了GVHD炎症,但在动物模型中,ISCs保留了较低的再生能力,导致恢复不良,并增加了非致命辐射暴露等挑战的死亡率。更多的研究正在设计策略,帮助ISCs '忘记'他们遇到的炎症,增强他们抵御免疫攻击的能力。”
参考资料
[1] Inflammation-induced epigenetic imprinting regulates intestinal stem cells



